
【题目】由几种离子化合物组成的混合物中含有以下离子中的若干种:K+、Cl-、NH![]() 、Mg2+、Ba2+、CO
、Mg2+、Ba2+、CO![]() 、SO
、SO![]() 。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验。
。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验。
实验序号 | 实验内容 | 实验结果 |
1 | 加入AgNO3溶液 | 有白色沉淀生成 |
2 | 加入足量NaOH溶液并加热 | 收集到气体1.12 L(标准状况下) |
3 | 加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后过滤、洗涤、干燥、称量 | 第一次称量读数为6.27 g,第二次称量读数为2.33 g |
请回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断原混合物中一定不存在的离子是________。
(2)试确定100 mL溶液中一定存在的阴离子及其物质的量浓度(可不填满)。
阴离子符号 | 物质的量浓度(mol·L-1) |
_______ | ___________ |
______ | _______________ |
(3)K+是否存在?________(填“存在”或“不存在”),判断的理由是____________________。
【答案】 不能确定 Ba2+、Mg2 SO![]() 0.1 CO
0.1 CO![]() 0.2 存在 溶液中肯定存在的离子是NH
0.2 存在 溶液中肯定存在的离子是NH![]() 、CO
、CO![]() 和SO
和SO![]() 。经计算,100 mL溶液中NH
。经计算,100 mL溶液中NH![]() 的物质的量为0.05 mol,CO
的物质的量为0.05 mol,CO![]() 、SO
、SO![]() 的物质的量分别为0.02 mol、0.01 mol,根据电荷守恒可判断K+一定存在
的物质的量分别为0.02 mol、0.01 mol,根据电荷守恒可判断K+一定存在
【解析】试题分析:根据题意,Ba2+和SO42-,可发生离子反应生成BaSO4↓,因此两者不能共存.Ba2+和CO32-可发生离子反应生成BaCO3↓,因此两者也不能共存,第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-.
第二份加足量NaOH溶液加热后,收集到气体0.05mol,和NaOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+.故可确定一定含有NH4+,一定不存在Mg2+.根据反应NH4++OH-═NH3↑+H2O,产生NH3为0.05mol,可得NH4+也为0.05mol;第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓,因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解.因此溶液中一定存在CO32-、SO42-,一定不存在Ba2+.由条件可知BaSO4为2.33g,物质的量为![]() =0.01mol,BaCO3为6.27g-2.33g═3.94g,物质的量为
=0.01mol,BaCO3为6.27g-2.33g═3.94g,物质的量为![]() =0.02mol.由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol;一定不存在Mg2+、Ba2+;CO32-、SO42-所带负电荷为0.02mol×2+0.01mol×2=0.06mol,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.01 mol,当K+物质的量>0.01 mol时,溶液中还必须含有Cl-;当K+物质的量="0.01" mol时,溶液中不含有Cl-;
=0.02mol.由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol;一定不存在Mg2+、Ba2+;CO32-、SO42-所带负电荷为0.02mol×2+0.01mol×2=0.06mol,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.01 mol,当K+物质的量>0.01 mol时,溶液中还必须含有Cl-;当K+物质的量="0.01" mol时,溶液中不含有Cl-;
(1)实验1加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-,实验1不能确定含有Cl-,依据上述分析可知Cl-可能含有;
由上述分析可知,溶液中一定不含有Mg2+、Ba2+;答案为:不能确定;Mg2+、Ba2+;
(2)依据上述分析可知,溶液中一定存在的阴离子为CO32-、SO42-,
SO42-物质的量为0.01mol,SO42-物质的量浓度=![]() =0.1mol/L,
=0.1mol/L,
CO32-物质的量为0.02mol,CO32-物质的量浓度为![]() =0.2mol/L,答案为:
=0.2mol/L,答案为:
阴离子符号 | 物质的量浓度(mol·L-1) |
SO42-(1分) | 0.1(2分) |
CO32-(1分) | 0.2(2分) |
(3)溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol.CO32-、SO42-所带负电荷分别为0.02mol×2+0.01mol×2=0.06mol,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在,答案为:存在;溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol;CO32-、SO42-所带负电荷为0.02mol×2+0.01mol×2=0.06mol,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在。


科目:高中化学 来源: 题型:
【题目】下列有关烃类物质的说法正确的是( )
A. 石油通过减压分馏可以得到相对分子量较大的芳香烃
B. 丙烯与溴的四氯化碳溶液反应生成1,3-二溴丙烷
C. ![]() 中至少有16个原子共平面
中至少有16个原子共平面
D. ![]() 的一氯代物的同分异构体有12种
的一氯代物的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验操作中,正确的是( )
|
|
|
|
A.配制硫酸溶液时,将浓硫酸慢慢注入盛有水的容量瓶中进行配制 | B.用托盘天平称量药品时,将药品置于天平左盘 | C.将混合液蒸馏分离时,应使温度计水银球浸没在混合液中 | D.分液时,将上下层液体依次从分液漏斗下口分别流入两个烧杯中 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
阴离子 | Cl- CO32— NO3— SO42— SiO32— I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是_____________________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈_______________________________________________性,原因是_________________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________________________________________________________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含H+、SO42-、NO3-三种离子,其中H+、SO42-的物质的量浓度分别为7.0 mol·L-1和2.0 mol·L-1。取该溶液20 mL,加入3.2 g铜粉,加热使它们充分反应,产生的气体在标准状况下的体积约为( )
A. 0.75 LB. 0.336 LC. 1.5 LD. 0.448 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用下列装置探究氯气与氨气的反应.其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
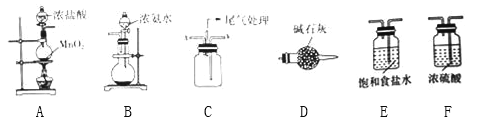
(1)若Cl2从左向右流动,NH3从右向左流动,则上述实验装置中,依次连接的合理顺序为:A→________________→B;为使NH3与Cl2更充分混合,Cl2应从C装置的__口进入(填“x”或“y”).
(2)简述装置A中使用分液漏斗向圆底烧瓶中滴加浓盐酸的操作是__________________.
(3)装置A中发生反应的离子方程式为_______________________________.
(4)装置B中圆底烧瓶内的试剂为______________(填名称).
(5)装置D的作用是____________________________.
(6)反应开始后,装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气中的主要成分之一,该反应的化学方程式为________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法一定正确的是( )
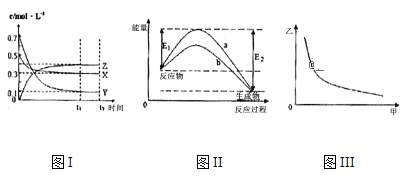
A.该反应的热化学方程式为X(g) +3Y(g) 2Z(g) △H= -(E2-E1)kJ
B.若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线
C.该温度下,反应的平衡常数数值约为533,若升高温度,该反应的平衡常数减小,Y的转化率降低
D.图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com