
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅单质既不能与酸反应又不能与碱反应 | |
| B. | 晶体硅中每个硅原子与另外四个硅原子形成4个共价键 | |
| C. | 硅与NaOH溶液的反应中NaOH作氧化剂 | |
| D. | 硅元素在地壳中的含量居第一位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
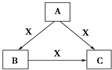 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若X为O2,则A可为硫化氢 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为Cl2,则C可为FeCl3 | |
| D. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
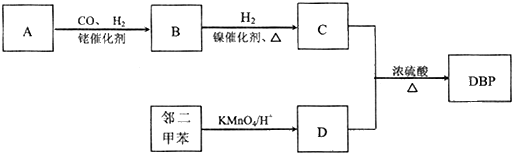
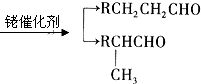
 .
.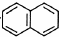 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Ca2+>Cl->S2- | B. | 第一电离能:Si>C>N | ||
| C. | 电负性:F>S>Mg | D. | 热稳定性:SiH4>H2S>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.4 | B. | 9.6 | C. | 6 | D. | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com