
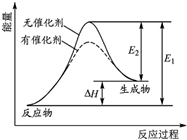
 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能改变反应的焓变 | |
| C. | 催化剂能改变反应的路径,降低反应所需的活化能 | |
| D. | △H=E1+E2 |
分析 A.图中反应物比生成物能量的低;
B.正逆反应活化能之差等于反应热;
C.正逆反应活化能之差等于反应热;
D.逆反应的活化能为E2,正反应的活化能E1,结合图分析.
解答 解:A.图象中反应物能量低于生成物能量,故反应是吸热反应,故A错误;
B.因为正逆反应活化能之差不变,催化剂降低了反应的活化能,即正反应活化能减小,逆反应活化能也减小,反应的焓变不变,故B错误;
C.因为正逆反应活化能之差不变,催化剂降低了反应的活化能,即正反应活化能减小,逆反应活化能也减小,催化剂能改变反应的路径,故C正确;
D.逆反应的活化能为E2,正反应的活化能E1,△H=E1-E2,故D错误;
故选C.
点评 本题考查了化学反应的能量变化,明确催化剂的作用实质是解题的关键,注意把握图象识别和理解含义,题目难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:推断题
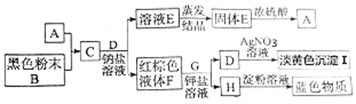
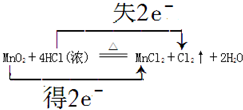 .该反应中的氧化剂是二氧化锰.
.该反应中的氧化剂是二氧化锰.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| B. | 已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1,则有反应HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3kJ•mol-1 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 已知氧气较臭氧稳定,则3O2(g)═2O3(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com