
| A. | 0.1mol O2完全反应时,转移的电子数为0.4NA | |
| B. | 用惰性电极点解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| D. | 1mol 葡萄糖与足量的钠反应能产生2.5mol H2 |
分析 A、氧气反应后可能变为-2价,还可能变为-1价;
B、用惰性电极点解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则说明阳极生成的是0.1mol氧气,阴极生成的是0.1mol铜和0.1mol氢气;
C、一个胶粒是多个氢氧化铁的聚集体;
D、葡萄糖是多羟基的醛.
解答 解:A、氧气反应后可能变为-2价,还可能变为-1价,故0.1mol氧气反应后转移的电子数可能为0.4NA个,还可能为0.2NA个,故A错误;
B、用惰性电极点解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则说明阳极生成的是0.1mol氧气,阴极生成的是0.1mol铜和0.1mol氢气,而由于氧气的生成是由-2价变为0价,故可知当生成0.1mol氧气时,阳极失去0.4NA个电子,故B错误;
C、一个胶粒是多个氢氧化铁的聚集体,故1mol氯化铁形成的胶粒的个数小于NA个,故C错误;
D、葡萄糖是多羟基的醛,结构中5个-OH,故1mol葡萄糖能和5mol金属钠反应生成2.5mol氢气,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:解答题
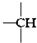 、
、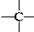 其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:
其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的Na2CO3溶液加适量水稀释后,溶液中$\frac{c(O{H}^{-})}{c(C{O}_{3}^{2-})}$变大 | |
| B. | 若使Na2S溶液中$\frac{c(N{a}^{+})}{c({S}^{2-})}$接近于2:1,可加入适量的KOH固体 | |
| C. | 0.1mol/LNaOH溶液和0.2mol/LCH3COOH溶液等体积混合后溶液中各离子浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 已知0.1mol/L NaH2PO4水溶液显酸性,则溶液里各种离子浓度由大到小的顺序是c(Na+)>c(H2PO4-)>c(HPO42-)>c(H+)>c(PO43-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com