
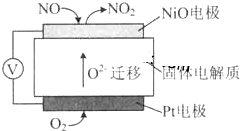
| A、NiO电极是该电池的正极 |
| B、Pt电极附近的pH增大 |
| C、NiO电极的电极反应式:NO-2e-+O2-═NO2 |
| D、固体电解质中O2-向正极移动 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 |
| B、向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 |
| C、将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝的熔点高于铝 |
| D、将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气的体积为1.12L |
| B、原烧碱溶液中含溶质离子0.2NA |
| C、所得溶液中含OH-的数目为1×10-5NA |
| D、所得溶液中C1O-的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氟酸的电离过程是吸热的 |
| B、当V=20时,溶液中:c(F-)<c(Na+)=0.1mol?L-1 |
| C、当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-) |
| D、当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡时,4v正(O2)=5v逆(NO) |
| B、若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C、达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减小,平衡正向移动 |
| D、化学反应速率关系是:2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com