
【题目】铋及其化合物在冶金、医疗、化工生产中均有重要作用。铋在自然界中的含量极少,常以游离金属和矿物的形式存在。对浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2、Cu2S、FeS2等杂质)通过浸出、净化和电沉积法分离回收铋的流程:

已知:I.“氯化浸出”过程中,需分批多次加入NaC1O3,以防生成Cl2;
II.BiCl3极易水解生成不溶性的BiOCl沉淀,但在浓盐酸中几乎不水解;
III.氧化性:Fe3+>Cu2+>Bi3+>H+.
请回答以下问题:
(1)“氯化浸出”时,为了提高浸取速率,可采取的措施有________________(任写一条);加入过量盐酸的主要目的是______________________.
(2)浸出渣中含有S和____________(写化学式);浸出液中所含的金属阳离子有Na+、Bi3+及___________________.
(3)写出“氯化浸出”中Bi2S3所发生反应的离子方程式__________________________.
(4)“还原”过程中所发生反应的离子方程式为2Bi+3Cu2+=2Bi3++3Cu及____________。
(5)“电解”过程的简易装置如图所示。装置中N为电源的______________(填“正”或“负”)极;阳极上发生的主要电极反应式为__________________________。

【答案】粉碎矿石(或适当提高浸取时温度合理答案) 抑制BiCl3水解生成不溶性沉淀,提高铋的浸出率 SiO2.. Cu2+、Fe3+ ClO3-+Bi2S3+6H+=3S↓+Cl-+2Bi3++3H2O Bi+3Fe3+=Bi3++3Fe2+ 负 Cl--6e-+6OH-=ClO3-+3H2O
【解析】
辉铋矿(主要成分为Bi2S3,还含少量Bi2O3、SiO2、Cu2S、FeS2等杂质)加入盐酸调节pH,并加入NaClO3,发生反应:Bi2S3+NaClO3+6HCl=2BiCl3+3S+NaCl+3H2O、Bi2O3+6HCl= 2BiCl3+ 3H2O,3Cu2S+2NaClO3+12HCl=6CuCl2+3S+2NaCl+6H2O、2FeS2+NaClO3+6HCl=2FeCl3+4S+NaCl+3H2O,SiO2不溶,得到浸出渣为SiO2和S,浸出液中含有Bi3+、Cu2+、Fe3+,滤液中加入铋粉还原铁离子:3Fe3++Bi=Bi3++3Fe2+,加入硫化氨沉淀Cu2+,则净化液中阳离子含有Bi3+、H+和NH4+、Na+、Fe2+,将净化液与混有少量的氢氧化钠溶液电解得到铋,则石墨电极净化液的电极反应为:Bi3++3e-=Bi,发生还原反应,作阴极,故钛板为阳极发生氧化反应:Cl--6e-+6OH-=ClO3-+3H2O,c为阴离子交换膜,据此分析解答。
(1)“氯化浸出”时,为了提高浸取速率,可采取的措施有粉碎矿石(或适当提高浸取时温度合理答案);浸出液中含有Bi3+,结合已知信息II,BiCl3极易水解生成不溶性的BiOCl沉淀,但在浓盐酸中几乎不水解,则加入过量盐酸的主要目的是抑制BiCl3水解生成不溶性沉淀,提高铋的浸出率
(2)根据分析,浸出渣中含有S和SiO2;浸出液中所含的金属阳离子有Na+、Bi3+及Cu2+、Fe3+;
(3)根据分析,“氯化浸出”中Bi2S3所发生反应的离子方程式ClO3-+Bi2S3+6H+=3S↓+Cl-+2Bi3++3H2O;
(4)“还原”过程中所发生反应的离子方程式为2Bi+3Cu2+=2Bi3++3Cu及铋粉还原铁离子,离子方程式为:3Fe3++Bi=Bi3++3Fe2+;
(5)根据分析,净化液中阳离子含有Bi3+、H+和NH4+、Na+、Fe2+,将净化液与混有少量的氢氧化钠溶液电解得到铋,则石墨电极净化液的电极反应为:Bi3++3e-=Bi,发生还原反应,作阴极,电解池中阴极与电源的负极相连,则N为负极;钛板为电解池阳极发生氧化反应:Cl--6e-+6OH-=ClO3-+3H2O。


科目:高中化学 来源: 题型:
【题目】Ⅰ.现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。在850℃时,K=1。
CO2(g)+H2(g) △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K__________1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向_____________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是_______________。
Ⅱ.在一固定容积的密闭容器中,保持一定温度,在一定条件下发生以下反应:2A(g)+B(g)![]() 3C(g),已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
3C(g),已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
(3)达到平衡时,C在反应混合气体中的体积分数是___(用含a的代数式表示)。
(4)在相同的实验条件下,若在同一容器中改为加入2 mol A和4 mol B,达到平衡后,C的物质的量为___mol(用含a的代数式表示)。此时C在反应混合气体中的体积分数与原平衡相比___(填“增大”“减小”或“不变”)。
(5)在相同实验条件下,若在同一容器中改为加入2 mol A和5 mol B,若要求平衡后C在反应混合气体中的体积分数仍与原平衡相同,则还应加入___mol C。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:①称取ng草酸晶体配成100.00mL水溶液;②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为amol·L-1的KMnO4溶液滴定,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。反应生成MnSO4在水溶液中基本无色,试回答下列问题:
(1)实验台上有以下仪器,实验中不需要的是___(填序号)。
a.托盘天平(带砝码、镊子) b.滴定管 c.100 mL容量瓶 d.烧杯 e.漏斗 f.锥形瓶 g.玻璃棒 h.药匙 i.烧瓶
(2)实验中KMnO4溶液应装在___式滴定管中,原因是___。
(3)滴定过程中用去VmLamol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为__mol·L-1,由此可计算x的值为___。
(4)若滴定终点读数时俯视,则计算出的x值可能__(填偏大、偏小、无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用可逆反应N2(g)+3H2(g) ![]() 2NH3(g)合成氨,下列叙述正确的是( )
2NH3(g)合成氨,下列叙述正确的是( )
A.合成氨的适宜条件是高温高压催化剂,其中催化剂不改变该反应的逆反应速率
B.恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 铝粉投入NaOH溶液中:2Al+2OH-===2AlO2-+H2↑
B. Na与CuSO4溶液反应:Cu2++2Na===2Na++Cu
C. 向AlCl3溶液中加入足量的氨水:Al3++3OH-===Al(OH)3↓
D. Ba(OH)2溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题。
(Ⅰ)下列一组有水参与的反应
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
⑤2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是_____________(填编号)。
(2)在这些氧化还原反应中,水既作氧化剂,又作还原剂是___________(填编号),水既不作氧化剂,又不作还原剂是__________(填编号)。
(3)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?___________(填“是”或“不是”),若是,这个反应的氧化剂和还原剂的质量比是________;
(Ⅱ)写出下列反应的离子方程式
①铜片与稀硝酸的反应_____________________________________;
②往氯化铝溶液中加入过量的NaOH溶液______________________;
(Ⅲ)写出下列反应的化学方程式
①二氧化硫发生催化氧化反应_________________________________;
②制漂白液的反应____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,V升容器中加入a mol HI使之分解:2HI(g) ![]() H2(g)+I2(g),反应达到平衡状态后,下列推测正确的是( )
H2(g)+I2(g),反应达到平衡状态后,下列推测正确的是( )
A. 减压时,v(逆)增大,v(正)减小,平衡向逆反应方向移动
B. 若加入2a mol HI,则平衡常数变为2倍
C. 加压时,v(逆)、v(正)均不变,平衡不移动
D. 若保持压强不变,通入氦气,则v(逆)、v(正)均减小,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:①![]()
②![]()
③![]()
试据此写出一氧化碳燃烧的热化学方程式___________________________。
Ⅱ.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
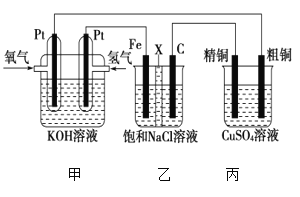
①石墨电极为________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液先变红。乙池中电解总方程式为____________。
②如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,溶液中硫酸铜浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为______________________。
③若在标准状况下,有224 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为________mL;丙装置中阴极析出铜的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0
B. △H2>0,△H4>0
C. △H1=△H2+△H3
D. △H3=△H4+△H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com