
| A. | 能使品红溶液褪色 | B. | 能使石蕊试液先变红再褪色 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能使滴有酚酞的NaOH溶液褪色 |
分析 SO2性质有:①具有酸性氧化物的通性;②具有还原性,被氧化剂氧化成SO3;③弱氧化性;④漂白性,能够和某些有色物质结合生成无色物质,但是不能漂白酸碱指示剂,以此解答该题.
解答 解:A.SO2具有漂白性,能够和某些有色物质结合生成无色物质,但是不能漂白酸碱指示剂,能使品红溶液褪色,故A正确;
B.SO2具有酸性氧化物的通性,能够和水反应生成亚硫酸,能使石蕊试液变红,故B错误;
C.SO2具有还原性,被氧化剂氧化成SO3或者硫酸,故能使酸性KMnO4溶液褪色,故C正确;
D.SO2具有酸性氧化物的通性,能够和碱反应生成盐和水,故D正确;
故选B.
点评 本题考查二氧化硫的性质,为高频考点,侧重二氧化硫物理性质的考查,注重基础知识的夯实,注意相关物理性质的记忆,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 用氯化铁溶液腐蚀电路板:2Fe3++3Cu═2Fe+3Cu2+ | |
| C. | 硫酸镁溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 钠和冷水反应:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠与水反应:Na2O+H2O═Na++OH- | |
| B. | 氯化铝溶液与足量氨水反应:Al3++4OH-═AlO2-+2H2O | |
| C. | 氯化铝溶液与足量NaOH溶液反应:Al3++3OH-═Al(OH)3↓ | |
| D. | 氧化铝和适量的烧碱溶液反应:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 盐酸 | 50mL | 50mL | 50mL |
| m(混合物) | 9.2g | 14.2g | 27.6g |
| V(CO2)(标准状况) | 2.2L | 3.36L | 3.36L |
| A. | 混合物中NaHCO3、KHCO的物质的量之比为1:2 | |
| B. | 当混合物质量为14.2g时,50mL盐酸恰好完全反应 | |
| C. | 盐酸的物质的量浓度为3.0mol/L | |
| D. | 9.2g混合物加热,固体质量减少2.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 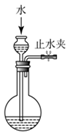 检查装置气密性 | |
| B. |  实验室制氨气 | |
| C. | 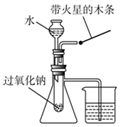 验证过氧化钠与水反应即生成氧气又放热 | |
| D. |  分离苯和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
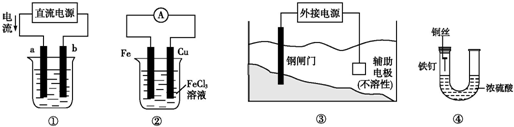
| A. | 用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Fe+2Fe3+═3Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的负极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com