
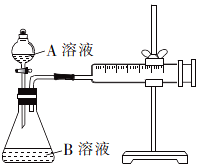
 草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.| 实验编号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
| ② | 2mL 0.2mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
| 实验编号 | 10%硫酸的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | - |
| Ⅱ | 2 | 20 | 少量MnSO4粉末 |
| Ⅲ | 2 | 30 | - |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
分析 (1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高;
(2)研究H2C2O4的浓度对化学反应速率的影响,应保证酸性KMnO4溶液体积、浓度相同;测定相同时间内收集到的气体体积来比较反应速率大小;
(3)研究催化剂对化学反应速率的影响,应保证温度、浓度相同;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同;
(4)实验Ⅰ和Ⅳ,硫酸的浓度不同,少量蒸馏水,溶液的体积相同.
解答 解:(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高,MnO4-为氧化剂,H2C2O4为还原剂,物质的量之比为2:5,
故答案为:2:5;
(2)酸性KMnO4溶液体积、浓度相同,但H2C2O4的浓度不同,故探究H2C2O4的浓度对化学反应速率的影响;通过测定相同时间内收集到的气体体积来比较反应速率大小,故还要用到秒表,
故答案为:H2C2O4的浓度;秒表;测定相同时间内收集到的气体体积(或者测定收集相同体积气体所用的时间;
(3)研究催化剂对化学反应速率的影响,应保证温度、浓度相同,则选实验Ⅰ、Ⅱ;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同,则选实验Ⅰ、Ⅲ,
故答案为:Ⅰ、Ⅱ;Ⅰ、Ⅲ;
(4)实验Ⅰ和Ⅳ,硫酸的浓度不同,可研究浓度对反应速率的影响,加少量蒸馏水确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同,
故答案为:确保两组实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
点评 本题考查氧化还原反应及影响反应速率的因素,注意控制变量法研究影响因素,把握表格中的数据分析及应用,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A<B<C | B. | 原子半径:A>B>C | ||
| C. | 离子半径:A2->C->B2+ | D. | 原子核外最外层电子数:A>C>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
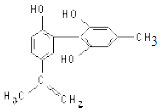 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂. 某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂. 某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇 FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入 KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| C. | 该分子中的所有碳原子不可能共平面 | |
| D. | 1 mol 该物质分别与浓溴水和 H2反应时最多消耗 Br2和 H2分别为 4 mol、7 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃放烟花产生的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 废旧电池应集中回收,并填埋处理 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视刻度线,会使所配溶液浓度偏大 | |
| B. | 将4.0gNaOH固体溶于1L水中可配成0.1mol/L的NaOH溶液 | |
| C. | 固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水到刻度线 | |
| D. | 称量时,将固体NaOH放在垫有纸的托盘天平左盘上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com