
分析 (1)步骤①是物质的量浓度的配制实验,使用的仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(2)根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降的总数相等进行解答;
(3)步骤③中,根据反应有碘单质被还原,所以选用淀粉作指示剂,依据碘单质恰好反应时蓝色褪去判断;
(4)若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,则消耗标准溶液体积增大,依据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,标准溶液体积增大;
(5)根据方程式中 I2、S2O32-之间的关系式计算.
解答 解:(1)步骤①是物质的量浓度的配制实验,使用的仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
(2)反应中Cr元素化合价由+6价降低到+3价,I元素化合价由-1价升高到0价,则根据化合价升降总数相等结合质量守恒可知配平后的方程式应为Cr2O72-+6I-+14H+=7H2O+2Cr3++3I2,故答案为:1;6;14H+; 7;2;3;
(3)步骤③中,根据反应有碘单质被还原,所以选用淀粉作指示剂,判断滴定达到终点的现象是当滴入最后一滴标准液,溶液的蓝色褪去,且半分钟内不变色,
故答案为:淀粉;当滴入最后一滴标准液,溶液的蓝色褪去,且半分钟内不变色;
(4)若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,则消耗标准溶液体积增大,依据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,标准溶液体积增大,100ml溶液中硫代硫酸钠的质量减小,测定结果偏小,
故答案为:偏小;
(5)根据方程式,Cr2O72-~3I2~6S2O32-
得C(S2O32-)=$\frac{10×0.01×6}{12}$=0.05mol/L,
m(Na2S2O3•5H2O)=248g/mol×0.05mol/L×0.1L=1.24g,
质量分数=$\frac{1.24g}{1.3000g}$×100%=95%,
故答案为:95%.
点评 本题主要考查了杂质离子的检测实验设计及其滴定法测定含量的过程,有关信息应用和化学方程式的计算,实验步骤判断是解题关键,题目难度中等.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:解答题
| 组别 | 镁铝合金质量.mg | HCl物质的量/mol | 氢气的体积/mL |
| 甲 | 255 | X | 280 |
| 乙 | 385 | X | 336 |
| 丙 | 459 | X | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +3 | B. | +2 | C. | -2 | D. | +1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | C6H5CH2CH=M | B. | CH2=CH2 | ||
| C. | C6H5CH2CH2C6H5 | D. | C6H5CH2CH=CHCH2C6H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )和D(
)和D( )按如下方法合成:
)按如下方法合成:
 +RCH2I→
+RCH2I→ +NaI
+NaI ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 向溶液乙中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ | |
| B. | 向溶液乙中滴加少量氢氧化钠溶液,一定出现红褐色沉淀 | |
| C. | 向溶液甲中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ | |
| D. | 该矿石一定为赤铁矿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
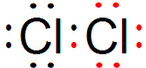 ,比较S2-与Cl-的半径大小:r(S2-)>(填“>”或“<”)r(Cl-).
,比较S2-与Cl-的半径大小:r(S2-)>(填“>”或“<”)r(Cl-).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 4-甲基-1-戊烯
4-甲基-1-戊烯 苯甲酸
苯甲酸




 B.
B. 与
与 C.
C. 与
与 D.
D. 与
与 E.
E. 与
与 F.2-甲基丁烷和2,2-二甲基丙烷.
F.2-甲基丁烷和2,2-二甲基丙烷.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com