
| ||
| 1 |
| 9 |
| 20g |
| 40g/mol |
| 1 |
| 2 |


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
| A、②⑨ | B、⑦⑧ |
| C、⑥⑦⑧ | D、②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、处理过程中银器一直保持恒重 |
| B、黑色褪去的原因是黑色Ag2S转化为白色AgCl |
| C、该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 |
| D、银器为正极,Ag2S被还原生成单质银 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 44.6 | 略 |
| S2Cl2 | -77 | 137 | S2Cl2、遇水生成HCl、SO2、S且温度过高容易分解(300度以上完全分解) |
| SCl2 | -121 | 59.6(分解) |
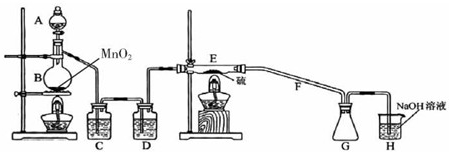
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com