
把NaHCO3和NaOH的混合物放在密闭容器中加热,下列关于混合物加热前后消耗盐酸的物质的量的判断正确的是( )
A.加热前消耗得多
B.加热后消耗得多
C.加热前后一样多
D.当NaOH适量时才会一样多
科目:高中化学 来源: 题型:
将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.3 mol·L-1 HCl B.4 mol·L-1 HNO3
C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、NH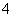 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO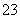 、SO
、SO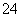 、NO
、NO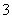 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
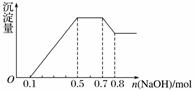
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH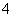 )=0.2 mol
)=0.2 mol
C.溶液中一定不含CO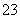 ,可能含有SO
,可能含有SO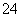 和NO
和NO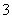
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)Na2O2与Na2O中均只存在离子键( )
(2)Na2O2与Na2O晶体中阳离子与阴离子的个数比均为2∶1( )
(3)2Na2O2+2H2O===4NaOH+O2↑
H2O既不是氧化剂也不是还原剂( )
(4)Na2O、Na2O2组成元素相同,与CO2反应产物也相同( )
(5)Na2O2的电子式为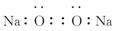 ( )
( )
查看答案和解析>>
科目:高中化学 来源: 题型:
碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,根据碱金属元素性质的递变规律预测其性质,其中不正确的是( )
A.在碱金属元素中它具有最大的原子半径
B.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
C.它的氢氧化物的化学式为FrOH,这是一种极强的碱
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示实验装置进行物质性质的探究实验。下列说法不合理的是( )
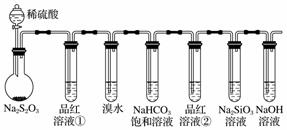
A.若品红溶液①褪色,则说明产物中含有SO2
B.若溴水褪色,则说明 SO2具有还原性
C.若烧瓶中产生黄色浑浊和无色气泡,则说明Na2S2O3只作氧化剂
D.若品红溶液②不褪色、Na2SiO3溶液中出现白色浑浊,则说明亚硫酸比碳酸的酸性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com