
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,单键中含有一个σ键,双键、三键中含有σ键和π键,结合分子的空间构型和电子式解答.
解答 解:①N2H4 中含有N-H键和N-N键,N原子上含有一个孤电子对;
②P4中含有P-P键,P原子上含有孤电子对;
③H2O中含有H-O键,O原子上含有孤电子对;
④N2 中含有N≡N键,N原子上含有孤电子对;
⑤H3O+ 中含有H-O键,O原子上有孤电子对;
⑥NH4+ 中含有H-N键,N原子上没有孤电子对;
⑦CO2 中含有C=O键,O原子上含有孤电子对;
⑧H2O2中含有O-H键和O-O键,O原子上含有孤电子对;
(1)既有极性键又有非极性键的是①⑧,故答案为:①⑧;
(2)既有σ键又有π键的是④⑦,故答案为:④⑦;
(3)微粒中不含孤电子对的是⑥,故答案为:⑥;
(4)立体构型呈正四面体的是②⑥,故答案为:②⑥.
点评 本题考查了键的极性和键的类型,题目综合性较强,侧重于基础知识的考查,题目难度不大,注意掌握键的极性的判断方法.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是高纯度的二氧化硅 | |
| B. | 古有“靑蒿一握,以水二升漬,绞取汁”,今用乙醚从黄花蒿中提取靑蒿素是利用氧化还原反应原理 | |
| C. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 | |
| D. | 纤维素作为营养物质,在人体内不断分解,最终生成水和二氧化碳排出体外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
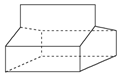 按要求回答问题:
按要求回答问题: ;
;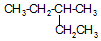 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
. ,如果要合成
,如果要合成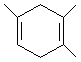 ,所用的原料可以是
,所用的原料可以是 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| B. | 已知电离常数H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| D. | 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
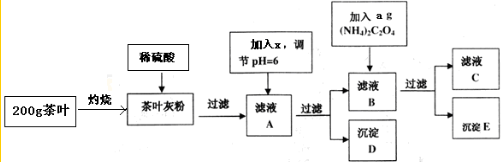
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
| 编号 | 终点时消耗KMnO4溶液体积(mL) |
| 1 | 19.98 |
| 2 | 22.00 |
| 3 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬铝的密度约为钢材的三分之一,是适合于做飞行器的材料 | |
| B. | 硬铝的强度比铝大得多,铝材比钢材的某些性能要好 | |
| C. | 硬铝的熔点跟铝相比有一定的提高,常被用于炊具 | |
| D. | 硬铝的抗腐蚀性较强,常被用于制门窗框架 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,浓度均为0.1 mol•L-1Na2S2O3和H2SO4溶液,各取5 mL、10 mL的Na2S2O3溶液分别与10 mL的H2SO4溶液混合反应,验证Na2S2O3浓度对反应速率的影响 | |
| B. | 通过测定室温下等浓度的HNO3和H2SO4溶液的pH值,比较元素N、S的非金属性强弱 | |
| C. | KI--I2溶液中存在如下平衡:I2+I-?I3-.取V1mI平衡混合溶液,滴加几滴淀粉,用c mol/L的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),滴定终点时消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可测定上述平衡体系中c(I2) | |
| D. | 确定铝片中氧化铝的含量:取一定质量的铝片,与过量的NaOH溶液充分反应,溢出的气体通过硅胶后,冷却至室温后准确测量其体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com