
(12分)工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g)CH3OH(g) ΔH =-akJ·mol-1
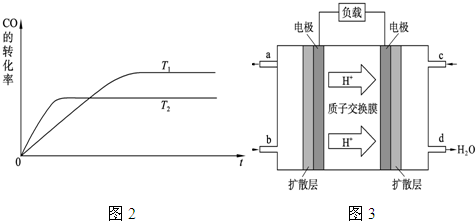
(1)上图是该反应在不同温度下CO的转化率随时间变化的曲线。
① a __0(填“>” “<” “=”)。
② 下列说法正确的是_ _(填序号)。
a.1 molCO(g) 和2 mol H2(g) 所具有的能量小于1 mol CH3OH(g) 所具有的能量
b.将1 molCO(g) 和2 mol H2(g) 置于一密闭容器中充分反应后放出a KJ的热量
c.升高温度,平衡向逆反应移动,上述热化学方程式中的a值将减小
d.如将一定量CO(g) 和H2(g)置于某密闭容器中充分反应后放热a KJ,则此过程中有1 mol CO(g) 被还原
(2)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示:
① 该合成路线对于环境保护的价值在于_ _。
② 15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2
吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因:
。
(3)甲醇燃料电池的工作原理如下左图所示。该电池工作时,c口通入的物质发生的电极
反应式为:_ _。
(4)以上述电池做电源,用上右图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
_ 。
(1)① >(2分) ②d(2分)
(2)① 有利于防止温室效应(2分)
② HOCH2CH2NH2 + H2OHOCH2CH2NH3++ OH-(2分)
(3) O2+4e-+4H+ = 2H2O(2分);
(4) Al-3e-=Al3+(1分) Al3++3HCO3- = Al(OH)3↓+3CO2↑(2分)
或Al-3e-+3HCO3- = Al(OH)3↓+3CO2↑(2分)
解析:考查外界条件对平衡的影响以及电化学的应用等。
(1)根据图像可知,温度为T2的曲线先达到平衡状态,所以T2大于T1。随着温度的升高,反应物的转化率是降低的,说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,a大于0;反应放热,说明反应物的总能量大于生成物的总能量,a不正确。反应是可逆反应,1 mol CO(g)和2mol H2(g)不可能生成1mol甲醇,所以放出的热量要小于akJ,b不正确。反应热与物质前面的化学计量数有关,与平衡的移动方向无关,c不正确。所以选项d是正确的。
(2)根据转化可知生成的CO2用来合成甲醇,所以有利于可知温室效应;根据乙酸胺的结构简式可知,分子中的氨基可以结合水电离出的氢离子,从而破坏水的电离平衡,使溶液中OH-浓度大于氢离子浓度,溶液显碱性。
(3)原电池中负极是失去电子的,甲醇在反应中是还原剂失去电子被氧化,因此甲醇在负极通入。根据燃料电池的结构可判断氢离子向右侧移动,所以右侧是正极,左侧电极是负极。因此氧气在右侧通入,所以c处的电极反应式为O2+4e-+4H+ = 2H2O。
(4)根据电解池的结构可知,铝是阳极,失去电子生成铝离子进入溶液中。由于电解质是碳酸氢钠溶液,所以生成的铝离子和碳酸氢钠水解相互促进,从而生成氢氧化铝沉淀。


科目:高中化学 来源: 题型:阅读理解
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| b-a-4c |
| 2 |
| b-a-4c |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| c(CH3OH) |
| c(CO)?c2H(2) |
| c(CH3OH) |
| c(CO)?c2H(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [CH3OH] |
| [CO][H2]2 |
| [CH3OH] |
| [CO][H2]2 |

| b-a-4c |
| 2 |
| b-a-4c |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com