
| | 实验目的 | 实验步骤及现象 |
| A | 检验Fe(NO3)2试样是否变质 | 试样加水溶解,加盐酸酸化,加KSCN溶液,出现血红色 |
| B | 检验某卤代烃是否是氯代烃 | 试样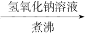 冷却 冷却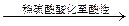 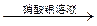 出现白色沉淀 出现白色沉淀 |
| C | 证明酸性条件H2O2氧化性比I2强 | NaI溶液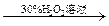 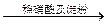 溶液变蓝色 溶液变蓝色 |
| D | 除去氯化钠晶体中少量硝酸钾 | 试样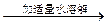 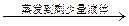 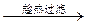 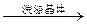 重结晶 重结晶 |
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源:不详 题型:填空题
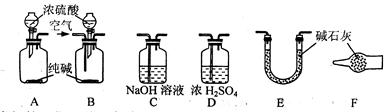 |
| 工业纯碱样品质量 | 反应前E的总质量 | 反应后E的总质量 |
| 6.4g | 51.9g | 54.1g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
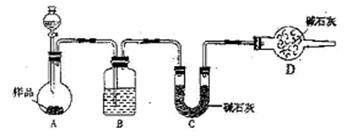
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.西瓜汁中含有丰富的葡萄糖和果糖,可用作还原糖鉴定的替代材料 |
| B.菠菜叶上表皮富含叶绿体,可以用作观察叶绿体的材料 |
| C.用高倍显微镜就可以观察到口腔上皮细胞中的线粒体,不需用电子显微镜 |
| D.显微镜下观察根尖的有丝分裂所用的材料必须始终处于活动状态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。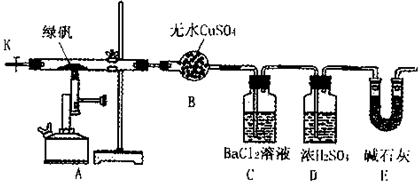
| | 实验记录 | 分析或计算结果 |
| 现象 | 硬质管内绿色变为红棕色; | 生成物有 |
| 干燥管B中晶体白色变蓝色。 | 生成物有H2O | |
| 数据 | 称取绿矾样品16.68g; | 反应的绿矾0.06mol |
| 干燥管E最后增重2.24g; | 生成SO2 mol | |
| C中生成白色沉淀的质量为4.66g; | 生成DO3 0.02mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原混合气体中一定没有CO、H2O,一定含有H2和CO2 |
| B.①②③④中都发生了氧化还原反应 |
| C.③中的反应为:CO2+3H2O+2CuSO4 ="===" Cu2(OH)2CO3+2H2SO4 |
| D.由①④说明,实验过程中一定有CO2生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.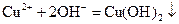 ,将 ,将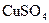 溶液滴入氨水中,振荡,会产生蓝色沉淀 溶液滴入氨水中,振荡,会产生蓝色沉淀 |
B.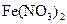 溶液中存在平衡: 溶液中存在平衡: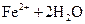 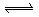 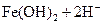 ,加入少量稀盐酸后溶液浅绿色会加深 ,加入少量稀盐酸后溶液浅绿色会加深 |
C.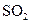 有漂白性,将 有漂白性,将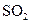 通入石蕊试液中,溶液将先变红后褪色 通入石蕊试液中,溶液将先变红后褪色 |
| D.硫酸铝溶液显酸性,次氯酸钠溶液显碱性,这两种溶液混合后会产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 Z+W
Z+W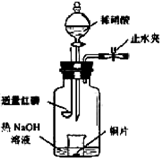
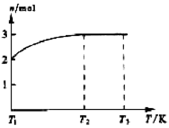
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 相关实验 | 预期目的 |
| A | 把等质量的两份同种大理石块中的一份研成粉末,在同温度下分别与等体积同浓度的盐酸反应,观察放出气体快慢。 | 验证触面积对化学反应速率的影响。 |
| B | 把装有颜色相同的NO2与N2O4混合气体的小试管(密封)分别浸入热水和冷水中,观察试管中气体颜色变化。 | 验证温度对化学平衡的影响。 |
| C | 直接将表面积相同的铝条和镁条投入同温度滴有酚酞的热水中,观察产生气泡的速率及溶液的颜色变化。 | 比较同周期金属元素的金属性强弱。 |
| D | 在装有同种浑浊的苯酚溶液的两个试管中,分别加入Na2CO3、NaHCO3固体,加热,观察溶液是否变澄清。 | 比较碳酸、苯酚和碳酸氢钠酸性的强弱。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com