
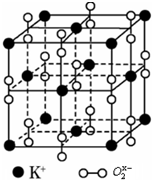
 如图是钾、氧元素形成晶体的一个晶胞,晶体中氧元素以O2x-离子形式存在.
如图是钾、氧元素形成晶体的一个晶胞,晶体中氧元素以O2x-离子形式存在.分析 ①根据晶胞图的结构可知,每个钾离子周围有6个O2-离子,每个O2-周围有6个钾离子,据此答题;
②根据均摊法可知,每个晶胞中含有钾离子的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有O2-离子的个数为12×$\frac{1}{4}$+1=4,据此确定化学式;
③以体心上O2-的为例,O2-周围最近且等距离的K+分布在周围6个面的面心上,所以6个K+围成的空间构型为正八面体,据此判断.
④根据平均化合价计算两种化合价的氧原子个数之比.
解答 解:①根据晶胞图的结构可知,每个钾离子周围有6个O2-离子,每个O2-周围有6个钾离子,所以晶胞结构与氯化钠相似,故选:A;
②根据均摊法可知,每个晶胞中含有钾离子的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有O2-离子的个数为12×$\frac{1}{4}$+1=4,所以晶胞中钾离子与O2-的个数比为1:1,所以化学式为KO2,O2x-中x的值为1;
故答案为:KO2;1;
③以体心上O2-的为例,O2-周围最近且等距离的K+分布在周围6个面的面心上,所以6个K+围成的空间构型为正八面体;
故答案为:正八面体;
④KO2中氧元素的平均化合价为-0.5,该晶体中0价氧原子和-2价氧原子的个数比为: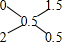 所以是1.5:0.5=3:1;
所以是1.5:0.5=3:1;
故答案为:3:1.
点评 本题考查了晶胞的计算,难度较大,会利用三轴进行切割是解本题的关键,这部分知识点是学习的难点,要多加练习巩固.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 取c(H+)=0.01mol•L-1的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO$_4^-$+6H++5H2O2=2Mn2++5O2↑+8H2O | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该反应类型属于消去反应.
,该反应类型属于消去反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向 NaAlO2溶液中通入过量二氧化碳:AlO2-+CO2+2H2O═Al(OH)3+HCO3- | |
| C. | 在强碱溶液中次氯酸钠与氢氧化铁反应生成 Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+4H+ | |
| D. | 向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2-═Al2S3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①②④⑤ | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青霉素G是一种良效广谱抗生素 | |
| B. | 青霉素在使用前不需要做皮肤敏感试验 | |
| C. | 青霉素在体内经酸性水解后,得到青霉氨基酸 | |
| D. | 青霉素的结构骨干中均有青霉酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
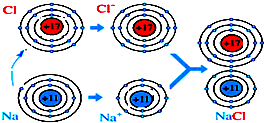
| A. | 上述过程中涉及的反应是氧化还原反应 | |
| B. | 上述过程中金属元素失去电子 | |
| C. | 上述过程中有电子的得失 | |
| D. | 离子间的反应也能形成共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com