
| A. | 实验前试管先用热的烧碱溶液洗涤,再用蒸馏水洗涤 | |
| B. | 向2%的硝酸银溶液中滴入2%的稀氨水,直至产生的沉淀恰好溶解,配得银氨溶液 | |
| C. | 采用水浴加热,不能直接加热 | |
| D. | 可用浓盐酸洗去银镜 |
分析 A、银镜反应实验要求试管必须洁净,试管中的油脂在碱性条件下发生水解反应;
B、配制银氨溶液时,若向2%的稀氨水滴加2%的硝酸银溶液,氨水过量会生成易爆炸的雷酸银(AgONC);
C、水浴加热能保证试管受热均匀,且易于控制反应温度,直接加热受热不均匀;
D、Ag能够和稀硝酸反应而溶解,不能与浓盐酸反应.
解答 解:A、油酯在碱性条件下发生水解反应,所以在做银镜实验准备洁净试管时,加氢氧化钠加热几分钟后,油脂水解生成高级脂肪酸钠和甘油,用蒸馏水冲洗即可得到干净的试管,故A正确;
B、配制银氨溶液时,若向2%的稀氨水滴加2%的硝酸银溶液,氨水过量会生成易爆炸的雷酸银(AgONC),因此配制银氨溶液时应将2%的稀氨水滴入2%的硝酸银溶液,直至产生的沉淀恰好溶解为止,故B正确;
C、水浴加热能保证试管受热均匀,且易于控制反应温度,而直接加热受热不均匀,不利于银镜的生成,故C正确;
D、Ag能够和稀硝酸反应而溶解,因此可用稀硝酸洗去试管内的银镜,不能利用浓盐酸,故D错误;
故选D.
点评 本题考查了乙醛的银镜反应,侧重于实验仪器和药品的准备、实验操作注意事项等,难度不大,此实验的关键是银镜的生成,注意银氨溶液的配制方法、乙醛和银氨溶液反应的化学方程式的书写.


科目:高中化学 来源: 题型:填空题
 烟气脱硫(SO2)脱硝(NOx)一体化技术是大气污染防治研究的热点.烟气中NO通常占NOx总量的90%以上,但NO的脱除难度较大.某研究小组探究用次氯酸钙溶液同时脱除烟气中SO2和NO的方法.
烟气脱硫(SO2)脱硝(NOx)一体化技术是大气污染防治研究的热点.烟气中NO通常占NOx总量的90%以上,但NO的脱除难度较大.某研究小组探究用次氯酸钙溶液同时脱除烟气中SO2和NO的方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
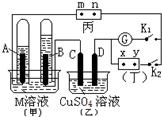 如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:
如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极板上覆盖有PbO2,负极板上覆盖有Pb | |
| B. | 该电池放电时的正极反应为PbO2(s)+4H+(aq)+SO2-4(aq)+2e-═PbSO4(s)+2H2O(l) | |
| C. | 该电池充电时,两个电极上都有PbSO4生成 | |
| D. | 用该电池电解饱和食盐水制氯气,若制得0.050molCl2,这时电池内消耗H2SO40.10mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com