

分析 (1)步骤②中,CN-被ClO-氧化为CNO-,因为是在碱性环境中,故ClO-只能被还原为Cl-,结合电荷守恒和原子守恒书写离子方程式;
(2)根据0.4 mol Cr2O72-等转化为Cr3+即可计算出转移电子的物质的量;
(3)加入熟石灰进一步处理,调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)反应后测得溶液pH=7,则可推知NaCN过量,根据电荷守恒和物料守恒即可计算出CN-和HCN的浓度,进而计算出Kh;
a.溶液中存在电荷守恒,阴阳离子电荷总数相同,电性相反;
b.溶液中存在物料守恒,浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后,溶液中钠离子物质的量的2倍等于HCN和CN-物质的量总和;
c.混合后得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,水解促进水的电离;
d.溶液混合后形成的是缓冲溶液,加入少量酸或碱,溶液酸碱性变化不大;
(5)SnCl2易水解,根据电子转移守恒与方程式可得关系式Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,据此计算.
解答 解:(1)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,离子反应为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
(2)根据0.4 mol Cr2O72-等转化为Cr3+,铬元素化合价降低3价,0.4molCr2O72-共得到了0.4×(2×3)mol=2.4mol;
故答案为:2.4;
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是调节废水pH,使其转化成Cr(OH)3沉淀除去;
故答案为:调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)由于反应后测得溶液pH=7,当a=0.01时,恰好反应,生成了氰化氢溶液,溶液显示酸性,故氰化钠应该多些,故a>0.01;
根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CN-)+c(Cl-),PH=7,c(H+)=c(OH-),c(CN-)=c(Na+)-c(Cl-)=$\frac{a}{2}$mol/L-$\frac{0.01}{2}$mol/L;
再根据物料守恒:c(CN-)+c(HCN)=c(Na+)=$\frac{a}{2}$mol/L,CN-的水解常数Kh=$\frac{c(HCN)×c(O{H}^{-})}{c(C{N}^{-})}$=$\frac{\frac{0.01}{2}×10{\;}^{-7}}{\frac{a-0.01}{2}}$=$\frac{10{\;}^{-7}}{100a-1}$;
若25℃时将浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后,混合后得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,溶液呈碱性,说明NaCN水解程度大于HCN的电离程度;
a.据电荷守恒可知c(H+)+c(Na+)=c(CN-)+c(OH-),此溶液一定有:c(Na+)+c(H+)=c(OH-)+c(CN-),故a正确;
b.由物料守恒可知c(HCN)+c(CN-)=0.1mol•L-1,所以c(HCN)+c(CN-)=2c(Na+),故b错误;
c.若25℃时将浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后,混合后得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,混合溶液中水的电离程度一定大于该温度下纯水的电离程度,故c正确;
d.若25℃时将浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后形成缓冲溶液,此溶液加入少量氢氧化钠抑制水解,促进电离,加入盐酸抑制电离促进水解,溶液酸碱性变化不大,所以溶液的pH变化不大,故d正确;
故答案为:$\frac{10{\;}^{-7}}{100a-1}$;b;
(5)SnCl2易水解,先溶于盐酸,然后用蒸馏水稀释至所需浓度;
令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7
Mg $\frac{1}{3}$mol
a×y bmol/L×$\frac{x}{1000}$L
解得y=$\frac{3xbM}{1000a}$,
故答案为:将SnCl2样品溶于盐酸,然后用蒸馏水稀释至所需浓度;$\frac{3xbM}{1000a}$.
点评 本题以工艺流程为载体,考查了氧化还原反应及离子方程式的书写,水溶液中的离子平衡、离子浓度、电离常数、沉淀溶解平衡等知识,培养学生的知识运用能力、灵活分析处理实际问题的能力,题目难度中等.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤ | C. | ③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

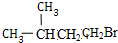 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +NaBr+H2O;
+NaBr+H2O; +HBr$\stackrel{△}{→}$
+HBr$\stackrel{△}{→}$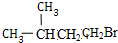 +H2O;
+H2O; ;
; 和
和 ;
;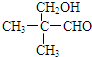 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 向醋酸溶液中加水可使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
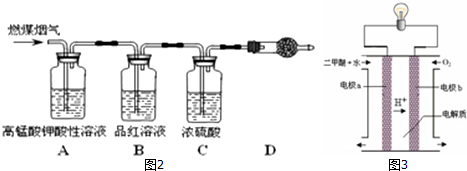
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤ | C. | ②③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳光通过门缝有光亮通路 | |
| B. | 一支钢笔使两种不同牌号的墨水,容易出现堵塞 | |
| C. | 向氯化铁溶液中加 NaOH溶液,会出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
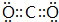 ;C 单质在高温下与B单质充分反应所得化合物的电子式为
;C 单质在高温下与B单质充分反应所得化合物的电子式为 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com