
分析 (1)根据化学式改写成相应的氧化物得形式,按照活泼金属氧化物.较活泼金属氧化物.SiO2.H2O得顺序来书写,并要遵守原子守恒来分析解答;
(2)氢氧化铝和盐酸反应生成三氯化铝和水;小苏打(NaHCO3)和盐酸反应生成氯化钠、水和二氧化碳;
(3)二氧化硅和氢氟酸反应生成四氟化硅;
(4)三价铁离子具有强的氧化性,能够氧化铜生成铜离子和二价铁离子;
(5)氯酸钠和浓盐酸反应能生成二氧化氯、氯气、水和氯化钠;
(6)在酸性条件下,SO2与高锰酸钾反应生成硫酸钾、硫酸锰和水.
解答 解:(1)铝的氧化物为Al2O3,硅的氧化物为SiO2,氢的氧化物为H2O,则根据活泼金属氧化物.较活泼金属氧化物.SiO2.H2O得顺序可知,[Al2Si2O5(OH)4]可改成Al2O3.2SiO2.2H2O,
故答案为:Al2O3.2SiO2.2H2O;
(2)氢氧化铝和盐酸反应生成三氯化铝和水:Al(OH)3+HCl=AlCl3+H2O,小苏打(NaHCO3)和盐酸反应生成氯化钠水和二氧化碳:NaHCO3+HCl=NaCl+H2O+CO2↑,生成二氧化碳会引起胃穿孔,
故答案为:Al(OH)3、NaHCO3;NaHCO3;
(3)玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅,反应方程式为SiO2+4HF=SiF4↑+2H2O,
故答案为:SiO2+4HF=SiF4↑+2H2O;
(4)三价铁离子具有强的氧化性,能够氧化铜生成铜离子和二价铁离子,离子方程式:Cu+2Fe3+=Cu2++2Fe2+,
故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(5)用NaClO3氧化浓盐酸制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,氯酸钠和浓盐酸反应的离子化学方程式为:2ClO3-+4H++2Cl-=Cl2↑+2ClO2+2H2O,
故答案为:2ClO3-+4H++2Cl-=Cl2↑+2ClO2+2H2O.
(6)在酸性条件下,SO2与高锰酸钾反应生成硫酸钾、硫酸锰和水,其反应的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;
故答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
点评 本题考查将复杂化合物写出氧化物的形式、方程式是书写、离子方程式,明确物质的性质是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
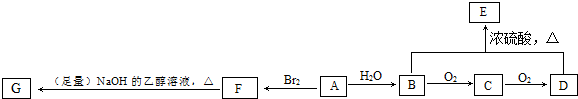
科目:高中化学 来源: 题型:解答题
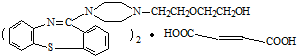 ,它的合成路线如下:
,它的合成路线如下: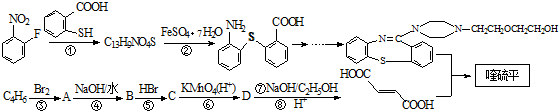
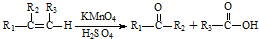
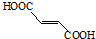 含有的官能团名称为碳碳双键和羧基.
含有的官能团名称为碳碳双键和羧基.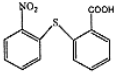 .
.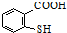 在一定条件下发生缩聚反应的化学方程式为
在一定条件下发生缩聚反应的化学方程式为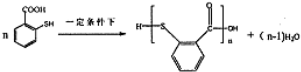 .
.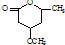 是一种重要的有机化合物.请设计合理方案,完成从
是一种重要的有机化合物.请设计合理方案,完成从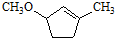 到
到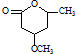 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃和硫酸亚铁溶液长期暴露在空气中均易变质 | |
| B. | SO2和CO2通入CaCl2溶液中均无明显现象 | |
| C. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| D. | SO2、漂白粉、活性炭都能使红墨水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、Fe2+、Cl-、NO3- | |
| C. | 在水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Fe3+、Cl-、NO3- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com