
【题目】镁与一定浓度的稀硝酸反应时,硝酸的还原产物为NH4NO3 . 现将一定量的镁粉投入200ml 稀硝酸中,两者恰好完全反应.若向反应后的溶液中加入过量的浓NaOH溶液并微热,溶液中有白色沉淀生成,同时有氨气逸出,且逸出的氨气干燥后全部被稀硫酸吸收,稀硫酸增重0.17g.试回答下列问题:
(1)根据上述信息写出Mg和硝酸反应的化学方程式: .
(2)发生还原反应的硝酸的物质的量为mol.
(3)参加反应的镁的质量为g.
(4)原稀硝酸的物质的量浓度为 molL﹣1 .
【答案】
(1)4Mg+10HNO3═4Mg(NO3)2+NH4NO3+3H2O
(2)0.01
(3)0.96
(4)0.5
【解析】解:(1)Mg和硝酸反应的产物是硝酸镁、硝酸铵和水,即4Mg+10HNO3═4Mg(NO3)2+NH4NO3+3H2O,
所以答案是:4Mg+10HNO3═4Mg(NO3)2+NH4NO3+3H2O;(2)稀硫酸增重0.17g为氨气的质量,其物质的量为0.01mol,根据氮原子守恒被氧化的硝酸与氨气的物质的量相等为0.01mol,
所以答案是:0.01;(3)根据电子转移守恒,参加反应Mg的物质的量= ![]() =0.04mol,
=0.04mol,
故参加反应的Mg的质量为0.04mol×24g/mol=0.96g,
所以答案是:0.96;(4)Mg与硝酸恰好完全反应生成Mg(NO3)2、NH4NO3,生成氨气为0.01mol,则n(NH4NO3)=0.01mol,Mg为0.04mol,则n[Mg(NO3)2]=0.04mol,
根据氮原子守恒可知原硝酸溶液中:n(HNO3)=2n[Mg(NO3)2]+2n(NH4NO3)=0.04mol×2+0.01mol×2=0.1mol,
故原硝酸的物质的量浓度为 ![]() =0.5mol/L,
=0.5mol/L,
所以答案是:0.5.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】在100mL 0.5mol/L AlCl3溶液中,加入100mL NaOH 溶液,得到2.34g 沉淀.则NaOH溶液物质的量浓度是(单位:mol/L)( )
A.0.6
B.0.9
C.1.6
D.1.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关高温结构陶瓷和光导纤维的说法正确的是( )
A.高温结构陶瓷具有耐高温、不怕氧化、耐酸碱腐蚀、硬度小、耐磨损、密度大的特点
B.氮化硅陶瓷抗腐蚀能力强,它不与任何无机酸反应
C.氧化铝陶瓷的熔点低,硬度小
D.光导纤维传导光的能力非常强,利用光缆通信,能同时传输大量信息
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A能与NaOH溶液反应,其分子中含有苯环,相对分子质量为136,其中含碳的质量分数为70.6%,氢的质量分数为5.9%,其余为氧.
(1)A的分子式是 .
(2)若A能与NaHCO3溶液反应放出CO2气体,其结构有种.
(3)若A与NaOH溶液在加热时才能反应,且1mol A消耗1mol NaOH,则A的结构简式可能是 .
(4)若A与NaOH溶液在加热时才能反应,且1mol A消耗2mol NaOH,则符合条件的A的结构可能有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测.
(1)冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
已知:I.As2 S3与过量的S2一存在以下反应:As2S3+3S2﹣2AsS ![]()
II.亚砷酸盐的溶解性大于相应砷酸盐
①亚砷酸中砷元素的化合价为 .
②砷酸的电离方程式为 .
③“一级沉砷”中FeSO4的作用是 .
④“二级沉砷”中H2 O2与含砷物质反应的化学方程式为 .
⑤沉淀X为(填化学式).
(2)冶炼废渣中的砷元素主要以As203的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0x 10 ﹣6g).
步骤1:取10g废渣样品,粉碎后与锌粉混合,加人H2 SO4共热,生成AsH3气体.
步骤2:将AsH3气体通人AgNO3溶液中,生成银镜和As2 O3 .
步骤3:取1g废渣样品,重复上述实验,未见银镜生成.
①AsH3的电子式为 .
②步骤2的离子方程式为 .
③固体废弃物的排放标准中,砷元素不得高于4.0×10一5gkg一1 , 请通过计算说明该废渣是否符合排放标准 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的说法中正确的是( )
A. 胶体外观不均匀
B. 胶体粒子不能通过滤纸
C. 胶体粒子作不停的、无秩序的运动
D. 胶体不稳定,静置后容易产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:![]() >H2CO3>
>H2CO3>![]() , 将
, 将 转变为
转变为![]() 的方法是( )
的方法是( )
A.与足量的NaOH溶液共热,再通入足量的CO2
B.与稀H2SO4共热后,加入足量的NaOH溶液
C.加热溶液,通入足量的CO2
D.与稀H2SO4共热后,加入足量的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.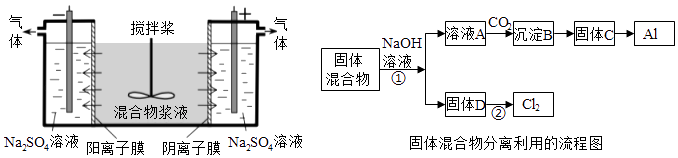
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .
a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .
Ⅱ含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com