
【题目】有一种含氧杂环化合物,在合成有机材料和药品中有重要应用、其结构如下图所示。下列关于该有机物的说法不正确的是

A. 1mol该有机物最多能消耗4mol NaOH
B. 1mol该有机物与H2反应时,最多消耗6mol H2
C. 该有机物的苯环上的一氯代物有3种
D. 该分子所有原子可能处于同一平面上
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验中能证明一种气体为SO2的是( )
①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红 ③使品红溶液褪色 ④通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生
A.都能证明
B.都不能证明
C.③④⑤能证明
D.只有⑤能证明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是
A. 用10mL量筒量取7.13mL稀盐酸
B. 用托盘天平称量25.20g NaCl
C. 用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
D. 用广泛pH试纸测得某溶液的pH为2.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B是出口,通过导线与直流电源相连。请回答以下问题:
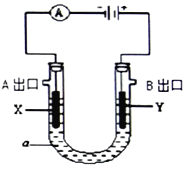
(1)若a是CuCl2溶液,则:
①X的电极名称是___________,电极反应式是_________________________。
②在B出口放一块湿润的KI-淀粉试纸会变为__________色。
(2)若a饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是______________。在X极附近观察到的现象是_____________。
②该电解池总反应式是___________________________________。
(3)若a是400mL2mol/LCuSO4溶液,一段时间阴极增重1.28g(该极无气体放出),电解后溶液体积不变,则溶液的pH为__________,阳极可收集标况下气体__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的物质,能满足如图中阴影部分关系的
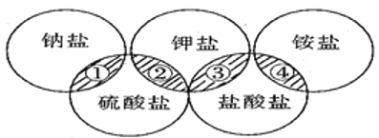
选项 | ① | ② | ③ | ④ |
A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
B | NaCl | K2SO4 | KCl | NH4Cl |
C | Na2SO4 | K2SO4 | KCl | NH4Cl |
D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,在指定条件下能大量共存的离子组是
A. 无色透明溶液中:Na+ 、Cu2+ 、Cl- 、S2
B. 遇酚酞试剂变红的溶液:Fe3+ 、K+ 、SO42 、NO![]()
C. 含有大量 CO32-的溶液:K+ 、 Ba2+ 、OH- 、SO42
D. 含有大量 H+ 的溶液:Mg2+ 、NH4+ 、NO3- 、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A. NaHCO3![]() Na+ + HCO3-
Na+ + HCO3-
B. CaCO3 = Ca2+ + CO32-
C. Cu(NO3)2 = Cu2+ + (NO3-)2
D. HClO = H+ + ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,在溶液中可发生以下两个反应:①Cl2 + 2Br- = Br2 + 2Cl-;②Br2 + 2Fe2+ = 2Fe3+ + 2Br-。现将标准状况下 1.12L 的氯气通入 1L 0.05mol/L 的 FeBr2溶液中,由此判断下列说法正确的是
A. 氧化性强弱:Cl2 > Fe3+ > Br2 B. 还原性强弱:Br- >Fe2+ >Cl-
C. 反应后溶液中 c(Fe3+):c(Br- ) =1:1 D. 反应后溶液中 c(Fe2+):c(Cl-) =1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用下图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。
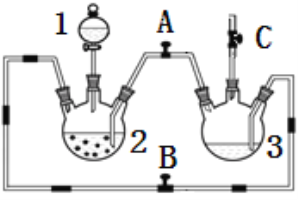
(1)稀硫酸应放在___________中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关______、打开开关_______就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由_________________.
(3)该实验使用铁粉,除反应速率可能太快外,还可能会造成的不良后果是__________________.
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O] (式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是__________。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为______________________.滴定终点的现象是_____________________.通过实验数据计算的该产品纯度为______________(用字母ac表).上表中第一次实验中记录数据明显大于后两次,其原因可能是_______。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com