
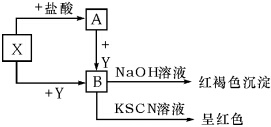
 常见金属X,有下列关系图,根据图示回答:
常见金属X,有下列关系图,根据图示回答:分析 金属X与盐酸反应生成A,A与Y反应生成B,而X与Y反应也生成B,B与NaOH反应反应得到红褐色沉淀,与KSCN溶液反应呈红色,则X为Fe、Y为Cl2、A为FeCl2、B为FeCl3,据此解答.
解答 解:金属X与盐酸反应生成A,A与Y反应生成B,而X与Y反应也生成B,B与NaOH反应反应得到红褐色沉淀,与KSCN溶液反应呈红色,则X为Fe、Y为Cl2、A为FeCl2、B为FeCl3.
(1)B与NaOH反应反应得到红褐色沉淀,与KSCN溶液反应呈红色,则B一定含有Fe3+,故答案为:Fe3+;
(2)X→A的反应方程式:Fe+2HCl═FeCl2+H2↑,故答案为:Fe+2HCl═FeCl2+H2↑;
(3)产生红褐色沉淀的离子方程式:Fe3++3OH-═Fe(OH)3↓,故答案为:Fe3++3OH-═Fe(OH)3↓.
点评 本题考查无机物推断,B与氢氧化钠溶液、KSCN溶液反应现象为推断突破口,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但以物质为主,如果物质没有变化,就不能引发能量的变化 | |
| B. | 氢能的优点是燃烧热值高,资源丰富,无毒无污染,且便于储存和运输,因此很可能成为未来的主要能源 | |
| C. | 对于在给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 离子反应的速率决定于溶液中离子的浓度和离子的扩散速率,受温度影响不大,是一类不需要活化能来引发的反应,所以反应速率很高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①③⑤⑥⑦ | C. | ①②③④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O=H2CO3分解反应 | |
| B. | Cu(OH)2$\frac{\underline{\;△\;}}{\;}$CuO+H2O 化合反应 | |
| C. | Fe2O3+3CO$\frac{\underline{\;△\;}}{\;}$2Fe+3CO2 置换反应 | |
| D. | NaCl+AgNO3=AgCl↓+NaNO3复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com