
| A. | 该溶液可由1L水中溶解0.1molBa(NO3)2制得 | |
| B. | 1L溶液中含有Ba2+和NO3-离子总数为3NA | |
| C. | 0.5L溶液中Ba2+离子的物质的量浓度为0.2 mol•L-1 | |
| D. | 0.5L溶液中NO3-离子的物质的量浓度为0.2 mol•L-1 |
分析 A.0.1mol硝酸钡溶于1L水中,所得溶液体积不是1L;
B.根据n=cV计算出1L该硝酸钡溶液中硝酸钡的物质的量,再计算出含有钡离子和硝酸根离子的总物质的量;
C.物质的量浓度与溶液体积无关,根据硝酸钡的化学式组成判断钡离子浓度;
D.根据硝酸钡的浓度计算出溶液中含有硝酸根离子的浓度.
解答 解:A.由1L水中溶解0.1molBa(NO3)2制得的溶液体积不是1L,所得溶液浓度不是0.1mol/L,故A错误;
B.1L 0.1mol•L-1Ba(NO3)2溶液中含有硝酸钡0.1mol,0.1mol硝酸钡中含有0.1mol钡离子、0.2mol硝酸根离子,总共含有0.3mol离子,含有Ba2+和NO3-离子总数为0.3NA,故B错误;
C.0.1mol•L-1Ba(NO3)2溶液中Ba2+离子的物质的量浓度为0.1 mol•L-1,故C错误;
D.0.1mol•L-1Ba(NO3)2溶液中NO3-离子的物质的量浓度为0.2 mol•L-1,故D正确;
故选D.
点评 本题考查了物质的量浓度的计算与判断,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意明确溶液浓度与溶液体积无关,与溶质的化学式组成有关,为易错点.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:填空题
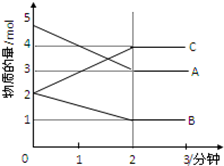 某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原醋酸物质的量浓度等于0.01mol•L-1 | |
| B. | 反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol•L-1 | |
| C. | 两种反应物中水电离出的c(H+)都是1×10-12mol•L-1 | |
| D. | 反应后的溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | H2 |
| B | 胆矾 | 石灰水 | 硫酸钡 | H2CO3 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 冰醋酸 | 福尔马林 | 苛性钾 | 氯化氢 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
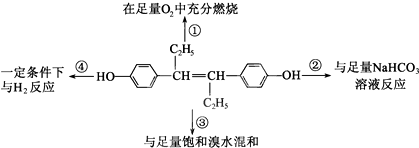
| A. | ①中生成7molH2O | B. | ②中生成2molCO2 | ||
| C. | ③最多消耗3molBr2 | D. | ④中最多消耗7molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
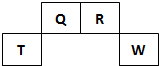 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.请回答下列问题: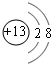 ;
;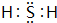 ,原子序数比W多1的元素其单质能使W的氢化物水溶液变浑浊,写出反应的化学方程式Cl2+H2S=S↓+2HCl;
,原子序数比W多1的元素其单质能使W的氢化物水溶液变浑浊,写出反应的化学方程式Cl2+H2S=S↓+2HCl;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com