
【题目】把18.0 mol·L-1的浓硫酸稀释成1.80 mol·L-1的稀硫酸100 mL,实验操作如下:
(1)请在下列操作步骤中填写有关的空格:
①用量筒量取________ mL的18.0 mol·L-1的浓硫酸;
②将__________沿烧杯内壁慢慢注入盛有少量__________的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入________ mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线__________处;
⑥改用__________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(2)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏大”“偏小”或“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水__________;
②摇匀后,发现溶液的液面低于刻度线,又加水至刻度线__________。
【答案】10.0 浓硫酸 蒸馏水 100 1~2 cm 胶头滴管 无影响 偏小
【解析】
(1)根据溶液稀释过程中溶质的物质的量不变计算出配制1.80mol/L的稀硫酸100mL,需要浓硫酸的体积,根据计算结果选择量筒规格;根据浓硫酸的正确稀释方法解答浓硫酸的稀释过程;根据配制一定物质的量浓度的溶液的正确方法完成各小题;
(2)根据实验操作对c= ![]() 的影响分析配制过程中产生的误差。
的影响分析配制过程中产生的误差。
(1)①配制1.80mol/L的稀硫酸100mL,需要18.0mol/L的浓硫酸的体积为![]() =0.01L=10mL,故答案为:10.0;
=0.01L=10mL,故答案为:10.0;
②稀释浓硫酸时,应该将浓硫酸沿着烧杯内壁慢慢注入蒸馏水中,顺序不能颠倒,故答案为:浓硫酸;蒸馏水;
③配制100mL溶液需要选用100mL容量瓶,故答案为:100;
⑤⑥定容时先直接加入蒸馏水,至容量瓶刻度线1-2cm时,改用胶头滴管进行定容,故答案为:1-2cm;胶头滴管;
(2)①容量瓶用蒸馏水洗涤后残留有少量的水,对溶液体积和溶质的物质的量都不产生影响,所以不影响配制结果,故答案为:无影响;
②摇匀后,发现溶液的液面低于刻度线,又加水至刻度线,导致配制的溶液体积偏大,溶液的浓度偏小,故答案为:偏小。


科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL 1.00mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是

A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列线条提示,画出Fe、Cu、S、H2、HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl 的树状分类图: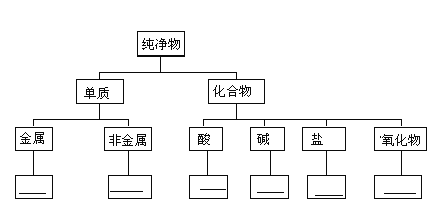
_____ _____ ____ ___ __ ___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.利用键长及键能的数据可判断:稳定性![]()
B.金属的电子气理论,可以解释金属易导电易腐蚀的原因
C.化学反应过程中一定有化学键的变化,这是反应过程中能量变化的本质原因
D.活化能越大就代表化学反应需要吸收或放出的能量就越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一体积恒定的密闭容器内发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是( )
C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是( )
A.气体的压强B.气体的总物质的量
C.气体的平均密度D.C和D的物质的量比是定值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.18 g冰水混合物中有NA个原子和10NA个电子
B.常温常压下16 g 氧气和臭氧混合气体含有NA个氧原子
C.标准状况下,33.6 L水含有1.5NA个水分子
D.2.24 L二氧化碳中含有0.3NA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列方法中可以证明 2HI(g) ![]() H2(g)+I2(g)已达平衡状态的是_________。
H2(g)+I2(g)已达平衡状态的是_________。
①单位时间内生成 n mol H2 的同时生成 n mol HI;
②一个 H—H 键断裂的同时有一个 H—I键断裂;
③百分组成ω(HI)=ω(I2);
④反应速率v(H2)=v(I2)= ![]() v(HI)时;
v(HI)时;
⑤c(HI):c(H2):c(I2)=2:1:1 时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均相对分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
(2)对于合成氨上述能说明达到平衡状态的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
A. 容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B. v正(CO2)=v逆(H2O)
C. 容器内混合气体密度保持不变
D. 3molH-H键断裂同时生成3molH-O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com