解:(1)一份加入足量Ba(OH)
2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,说明含有Fe
2+离子,加热该混合物,逸出0.224L(标准状况)能使湿润的红色石蕊试纸变蓝的气体,说明含有NH
4+,用稀盐酸处理上述粉末,洗涤和干燥,得到白色固体2.33g,说明含有SO
42-,白色沉淀颜色变化的反应化学方程式是氢氧化亚铁被氧气氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)
2+O
2+2H
2O=4Fe(OH)
3,
故答案为:Fe
2+;NH
4+;SO
42-;4Fe(OH)
2+O
2+2H
2O=4Fe(OH)
3;
(2)由题中信息可知1.96g的该结晶水合物中:
n(NH
4+)=
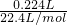
=0.01mol,质量为:m(NH
4+)=0.01mol×18g/mol=0.18g,
n(SO
42-)=
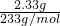
=0.01mol,质量为:m(SO
42-)=0.01mol×96g/mol=0.96g,
将沉淀过滤、洗涤并灼烧至恒重,得到固体粉末2.73g为硫酸钡和氧化铁的质量,m(BaSO
4)=2.33g,m(Fe
2O
3)=2.73g-2.33g=0.4g;
n(Fe
2O
3)=
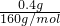
=0.0025mol;
即Fe
2+的物质的量为0.005mol,质量为:0.005mol×56g/mol=0.28g,
所以结晶水合物中水的质量为:1.96g-0.18g-0.96g-0.28g=0.54g,n(H
2O)=
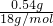
=0.03mol,
所以,1.96g的该结晶水合物中:
m(NH
4+):n(Fe
2+):n(SO
42-):n(H
2O)=0.01mol:0.005mol:0.01mol:0.03mol=2:1:2:6,
该结晶水合物的化学式为:(NH
4)
2Fe(SO
4)
2?6H
2O;[或(NH
4)
2SO
4?FeSO
4?6H
2O],
故答案为:(NH
4)
2Fe(SO
4)
2?6H
2O;[或(NH
4)
2SO
4?FeSO
4?6H
2O].
分析:一份加入足量Ba(OH)
2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,说明含有Fe
2+离子,加热该混合物,逸出0.224L(标准状况)能使湿润的红色石蕊试纸变蓝的气体,说明含有NH
4+,将沉淀过滤、洗涤并灼烧至恒重,得到固体粉末2.73g,分析反应过程可知得到固体粉末为硫酸钡和氧化铁的质量;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g,说明含有SO
42-,根据各物质的量和所发生的氧化还原反应进一步推断可能的化学式.
点评:本题考查离子的检验和推断,题目难度中等,注意从守恒的角度推断结晶水合物的化学式.

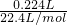 =0.01mol,质量为:m(NH4+)=0.01mol×18g/mol=0.18g,
=0.01mol,质量为:m(NH4+)=0.01mol×18g/mol=0.18g,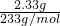 =0.01mol,质量为:m(SO42-)=0.01mol×96g/mol=0.96g,
=0.01mol,质量为:m(SO42-)=0.01mol×96g/mol=0.96g,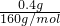 =0.0025mol;
=0.0025mol;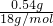 =0.03mol,
=0.03mol,


