
| A. | 乙烷和氯气取代 | B. | 乙烯和氢气加成后,在用氯气取代 | ||
| C. | 乙烯和氯化氢加成 | D. | 乙烯和氯气加成 |
分析 制备纯净的一氯乙烷,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,这时原子的利用率为100%,可通过加成反应制备,以此解答该题.
解答 解:A.乙烷和氯气取代:CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl,光照条件下,氯气和乙烷发生取代反应生成乙烷的多种氯代烃,同时HCl,所以不能制备较纯净的一氯乙烷,故A错误;
B.乙烯加成氢气:CH2═CH2+H2→CH3CH3,再用氯气取代:CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl,该反应有杂质HCl生成,不符合原子经济的理念,故B错误;
C.乙烯和氯化氢反应:CH2═CH2+HCl→CH3CH2Cl,生成物只有氯乙烷,符合原子经济理念,故C正确;
D.乙烯和氯气反应:CH2═CH2+Cl2→CH2ClCH2Cl,产物是二氯乙烷不是氯乙烷,故D错误;
故选C.
点评 本题以一氯乙烷的制备为载体考查加成反应、取代反应,注意题干中关键字“纯净”是解本题关键,注意取代反应和加成反应的区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

| 阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
| 浓度/mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | F |
| 原子半径/nm | 0.077 | 0.075 | 0.117 |
| 主要化合价 | +4、-4 | +5、-3 | +4、-4 |
| 元素 | D | M | G | E |
| 性质 结构 信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远. | 氢化物常温下呈液态,M的双原子阴离子有18个电子 | 原子核外的M层比L层少2个电子. | +3价阳离子的核外电子排布与氖原子相同. |
 ,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于分解反应、放热反应 | |
| B. | 该反应瞬间能产生大量高温气体,推动飞船飞行 | |
| C. | 该反应把化学能转变为热能和动能 | |
| D. | 该反应反应物的总能量小于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )| A. | ①加CCl4 ②加苯 ③加酒精 | B. | ①加酒精 ②加CCl4 ③加苯 | ||
| C. | ①加苯 ②加CCl4 ③加酒精 | D. | ①加苯 ②加酒精 ③加CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
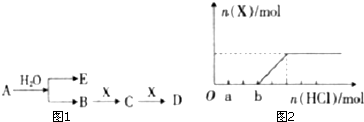
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com