
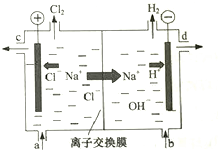
 �ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ����
�ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ�������� ��1����⾫�Ʊ���ʳ��ˮ�����������������ռ
��2�������ӽ���Ĥֻ��������ͨ���������Ӻ����岻��ͨ����
��3����ⱥ��ʳ��ʱ����������Cl-��OH-�ŵ磬Cl-�ķŵ�����ǿ��OH-�����������ķ���ʽΪ��2Cl--2e-�TCl2����������2H++2e-�TH2����H2��NaOH��������NaOH��Һ�ij���Ϊd��Cl2�����������Ʊ���ʳ��ˮ���������룻
��4��KClO3�Ͳ��ᣨH2C2O4�������������·�Ӧ����ClO2��CO2��KHSO4������������ԭ��Ӧ����������غ����д��ѧ����ʽ��
��5��H2SO3Ki1=1.54��10-2��Ki2=1.02��10-7��HClOKi1=2.95��10-8 ��˵��ClO-ˮ��̶ȴ���SO32-��
H2SO3Ki1=1.54��10-2 Ki2=1.02��10-7��H2CO3Ki1=4.3��10-7Ki2=5.6��10-11��˵��SO32-ˮ��̶�С��CO32-��
��� �⣺��1����⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ��Ӧ�����ӷ���ʽΪ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2����
�ʴ�Ϊ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2����
��2�������ӽ���Ĥֻ��������ͨ���������Ӻ����岻��ͨ������ʯī���缫��ⱥ���Ȼ���ʱ�������������ӷŵ�������������������ͨ�������ӽ���Ĥ�����������������������������������ϲ�����ը����������������Һ��Ӧ�����Ȼ��ơ��������ƶ�������ȡ���������Ʋ�����
�ʴ�Ϊ����ֹ�������ɵ��������������ɵ��������Ʒ�Ӧ��ʹ��Ʒ��������ֹ�������ɵ��������������ɵ�������Ӧ����Ӧ��������ȫ�¹ʣ�
��3�������������������ӷŵ�����������ˮ����ƽ�������������������Ũ��������������������Һ��NaOH��Һ�ij���Ϊd��
Cl2������������װ��ͼ������֪���Ʊ���ʳ��ˮ���������룬������Ϊa��
�ʴ�Ϊ��a��d��
��4��KClO3�Ͳ��ᣨH2C2O4�������������·�Ӧ����ClO2��CO2��KHSO4����Ӧ�ķ���ʽΪ��2KClO3+H2C2O4+2H2SO4�T2ClO2��+2CO2��+2KHSO4+2H2O��
�ʴ�Ϊ��2KClO3+H2C2O4+2H2SO4�T2ClO2��+2CO2��+2KHSO4+2H2O��
��5��H2SO3 Ki1=1.54��10-2��Ki2=1.02��10-7��HClOKi1=2.95��10-8 ��˵��ClO-ˮ��̶ȴ���SO32-��0.1mol/L NaClO��Һ��pH����0.1mol/L Na2SO3��Һ��pH�����ݵ���ƽ�ⳣ����С�Ƚϣ�H2SO3Ki1=1.54��10-2 Ki2=1.02��10-7��H2CO3Ki1=4.3��10-7Ki2=5.6��10-11��˵��SO32-ˮ��̶�С��CO32-��Ũ�Ⱦ�Ϊ0.1mol/L��Na2SO3��Na2CO3�Ļ����Һ�У�SO32-��CO32-��HSO3-��HCO3-Ũ�ȴӴ�С��˳��Ϊc��SO32-����c��CO32-��c��HCO3-����c��HSO3-����
�ʴ�Ϊ������c��SO32-����c��CO32-��c��HCO3-����c��HSO3-����
���� ���⿼���˵��ԭ���ķ������缫�����жϷ�������ѧ����ʽ��д����Ҫ��������ʵ���̶ȴ�С������ˮ���ԭ��Ӧ�ã�����Ũ�ȴ�С�Ƚϣ���Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | һ��ʱ���Zn�缫���ܽ� | |
| B�� | ��װ����Cu��Ϊ������������ԭ��Ӧ | |
| C�� | b����Ӧ�ĵ缫��ӦʽΪ��H2-2e-=2H+ | |
| D�� | ��������a�缫�� ��Cu�缫 ��Cu�缫 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2�� | B�� | 0.25mol | C�� | 3.01��1023�� | D�� | 1mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ɷ� | CaO | P2O5 | SO3 | CO2 |
| ����������%�� | 47.30 | 28.40 | 3.50 | 6.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ᡢ�Ҵ� | B�� | �Ҵ�����ȩ������ | ||
| C�� | �������ᡢ���Ȼ�̼ | D�� | �����������Ȼ�̼���Ҵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʯ��ׯ������ѧ�߶��Ͻο�һ��ѧ���������棩 ���ͣ�ѡ����
���ڱ���ϩ�� ���������������� ��ʹ����KMnO4��Һ��ɫ���� ��ʹ������Ȼ�̼��Һ��ɫ���� ������ˮ���� �����ڱ��У��� ����Ũ���ᷢ��ȡ����Ӧ���� ���е�ԭ�ӿ��ܹ�ƽ�档������ȷ���ǣ� ��
���������������� ��ʹ����KMnO4��Һ��ɫ���� ��ʹ������Ȼ�̼��Һ��ɫ���� ������ˮ���� �����ڱ��У��� ����Ũ���ᷢ��ȡ����Ӧ���� ���е�ԭ�ӿ��ܹ�ƽ�档������ȷ���ǣ� ��
A���٢ڢۢܢ� B���٢ڢݢ� C���٢ڢܢݢ� D��ȫ����ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʯ��ׯ������ѧ�߶��Ͻο�һ��ѧ���������棩 ���ͣ�ѡ����
�����й��к͵ζ��IJ��ֲ���˳����ȷ���ǣ� ��
�� ����Һ��ϴ�ζ��ܣ��� ���ζ�����ע�����Һ���� ���ζ����Ƿ�©ˮ���� �ζ����� ϴ�ӵζ��ܣ��� �����ζ�����Һ���ڡ�0����0�����¿̶ȣ�������
A���ݢ٢ڢۢܢޢ� B���ۢݢ٢ڢޢߢ� C���ۢݢڢߢ٢ޢ� D���ڢޢߢ٢ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�켪��ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ҹ���������������DZˮ�����е������DZ���飬�����ȴﵽ7062�ף�����ȫ���ء��䶯����Դ��Al-AgO��أ�ԭ����ͼ��ʾ������˵������ȷ����

A��Al�缫�Ǹõ�ص�����
B��Ag��AgO/Ag�缫�Ϸ���������Ӧ
C���õ�ظ�����Ӧ��2Al-6e����8OH����2AlO2����4H2O
D��AgO/Ag�缫������Һ�е�pH��С
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com