
| A、反应速率v(B)=0.25 mol?L-1?min-1 |
| B、该反应方程式中,x=1 |
| C、2min时,A的物质的量为1.5mol |
| D、2min时,A的转化率为60% |
| 1mol×3 |
| 2 |
| 1mol×1 |
| 2 |
| △c |
| △t |
| 1mol×3 |
| 2 |
| 1mol×1 |
| 2 |
| ||
| 2min |
| 1.5mol |
| 3mol |


科目:高中化学 来源: 题型:
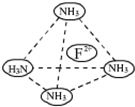 物质结构与性质A、B、C、D、E为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子2p原子轨道上有3个未成对的电子,且B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子.
物质结构与性质A、B、C、D、E为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子2p原子轨道上有3个未成对的电子,且B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Al能放出H2的溶液中:Mg2+、Cu2+、SO42-、NO3- |
| B、能使酚酞变红的溶液中:K+、Na+、Cl-、CO32- |
| C、无色透明的水溶液中:K+、Ba2+、I-、MnO4- |
| D、常温下,在c(H+)/c(OH-)=1×10-12的溶液中:Fe2+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某待测液加入AgNO3溶液,生成白色沉淀,说明原溶液中有Cl- |
| B、某待测液加入BaCl2溶液,生成白色沉淀,说明原溶液中有SO42- |
| C、某待测液加入CaCl2溶液,生成白色沉淀,说明原溶液中有CO32- |
| D、某待测液加入NaOH溶液,生成蓝色沉淀,说明原溶液中有Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、打开汽水瓶有气泡从溶液中冒出 |
| B、实验室用排饱和食盐水法收集氯气 |
| C、合成氨工厂采用增大压强以提高原料的转化率 |
| D、2NO2(g)═N2O4(g)的平衡体系中,加压缩小体积后颜色加深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com