
【题目】用![]() 高能原子轰击
高能原子轰击![]() 的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
A.112号元素的相对原子质量为277
B.此变化不属于化学变化
C.核素![]() 的原子核内有30个质子,40个中子
的原子核内有30个质子,40个中子
D.核素![]() 中的中子数比质子数多44
中的中子数比质子数多44
科目:高中化学 来源: 题型:
【题目】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1______K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
a .容器内N2,H2,NH3的浓度之比为1:3:2 b. υ(N2)正=3υ(H2)逆
c .容器内压强保持不变 d. 混合气体的密度保持不变
③在400℃时,当测得NH3和N2,H2的物质的量分别为1mol和2mol,3mol时,则该反应的υ(N2)正______υ(N2)逆(填写“>,“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的分子式为C11H20,1 mol 该烃在催化剂作用下可以吸收2 mol H2;用热的KMnO4酸性溶液氧化,得到下列三种有机物:
![]() HOOC—CH2CH2—COOH。
HOOC—CH2CH2—COOH。
已知:
![]()
 +R3-COOH(R1-、R2-、R3-代表烃基)
+R3-COOH(R1-、R2-、R3-代表烃基)
由此推断写出该烃可能的结构简式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mlbmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法不正确的是
A. b>0.01
B. 混合后溶液呈中性
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林是一种治疗心脑血管疾病的药物,可由化合物![]() 和
和![]() 在一定条件下合成得到(部分反应条件略)。
在一定条件下合成得到(部分反应条件略)。

请回答下列问题:
(1)![]() 的名称为______,
的名称为______,![]() 的反应类型为______。
的反应类型为______。
(2)![]() 的分子式是______。
的分子式是______。![]() 的反应中,加入的化合物
的反应中,加入的化合物![]() 与银氨溶液可发生银镜反应,该银镜反应的化学方程式为____________________________________。
与银氨溶液可发生银镜反应,该银镜反应的化学方程式为____________________________________。
(3)![]() 为取代反应,其另一产物分子中的官能团名称是____________。
为取代反应,其另一产物分子中的官能团名称是____________。![]() 完全燃烧最少需要消耗 ____________
完全燃烧最少需要消耗 ____________![]() 。
。
(4)![]() 的同分异构体
的同分异构体![]() 是芳香酸,
是芳香酸, ,
,![]() 的核磁共振氢谱只有两组峰,
的核磁共振氢谱只有两组峰,![]() 的结构简式为____________,
的结构简式为____________,![]() 的化学方程式为________________________。
的化学方程式为________________________。
(5)上图中,能缩合成体型高分子化合物的酚类单体是____________ ,写出能检验该物质存在的显色反应中所用的试剂及实验现象__________________________________________。
(6)已知:![]() 的原理为:①C6H5OH+
的原理为:①C6H5OH+ +C2H5OH和②
+C2H5OH和②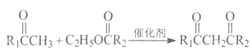 +C2H5OH,
+C2H5OH,![]() 的结构简式为____________。
的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,难溶电解质的饱和溶液中存在着沉淀溶解平衡,已知:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
25 ℃时,对于含Fe2(SO4)3、FeSO4和CuSO4各0.5 mol的1 L混合溶液,根据上表数据判断,下列说法不正确的是( )
A. 在pH=5的溶液中,Fe3+不能大量存在
B. 混合溶液中c(SO![]() )∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
)∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
C. 向混合溶液中逐滴加入0.1 mol·L-1NaOH溶液,最先看到红褐色沉淀
D. 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和K2SO4溶液。下列说法正确的是( )

A. b电极上发生还原反应
B. 外电路电流方向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为MnO4-+8H++5e-=Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为_____________,G的原子结构示意图是__________________________。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为_________,所含化学键类型为___________,向甲中滴加足量水时发生反应的化学方程式是____________________________。
(3)E、F、G三种元素形成的简单离子,半径由大到小的顺序是__________。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则a极是该电池的________极,正极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩10种元素在周期表中的位置。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,最不活泼的是(填元素符号,下同)________,金属性最强的是________,③④⑤三种元素的原子半径由大到小的顺序是________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式,下同),呈两性的氢氧化物是________。
(4)比较⑥和⑦氢化物的稳定性由强到弱的顺序是_______(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com