
【题目】下列属于氧化还原反应的是( )
A. MgCl2 + Ba(OH)2 == BaCl2 + Mg(OH)2↓
B. CO2 + 2NaOH == Na2CO3 + H2O
C. CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
D. 2H2+O2![]() 2H2O
2H2O
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物广泛用于蓄电池、机械制造、电缆护防等行业。
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为_________;
(2)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。
2PbSO4 +2H2O。
铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
(3)利用电解法可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。
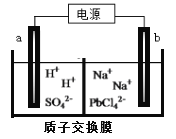
a电极的名称是__________,b电极的电极反应式为______________________
(4)PbO2可以通过石墨为电极电解Pb(NO3)2 和Cu(NO3)2的混合溶液制取。则阳极发生反应的电极反应式为______________,阴极上观察到的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种常见治疗胃病药品的标签:

① ② ③
这三种药品中所含的物质均能中和胃里过量的盐酸。
(1)请写出3种药片中有效成分与盐酸反应的离子方程式:
①_________________________________________________________________________;
②_________________________________________________________________________;
③_________________________________________________________________________。
(2)患胃溃疡的患者不能服用药片①,原因是___________________________________________________。
(3)某患者服用药片①2片后发生打嗝现象,请计算该患者服用该药片2片产生气体体积约______________mL。(体积按标准状况计算)
(4)下列关于三种药片中和胃酸的能力比较,正确的是_______________。
A.①=②=③ B.①>②>③ C.③>②>① D.②>③>①
(5)若按每片药片中和胃酸的量来衡量药效,则每服用药片③1片,相当于服用药片②________________________片。(精确到小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列两种说法:①一种碱溶液与一种盐溶液混合反应后,产物之一是强碱性物质;②两种酸溶液混合反应后,溶液的酸性减弱。其中确有具体例证存在的是 ( )
A.只有①B.①和②C.只有②D.都不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1molAl2(SO4)3跟350mL2mol/LNaOH溶液混合,所得沉淀的质量为
A.78g B.15.6g C.7.8g D.3.9g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1CH3COOH
溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了图1、图2两种实验装置. 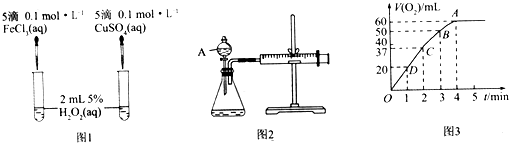
(1)若利用图1实验,可通过观察产生气泡的快慢定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 , 写出H2O2在二氧化锰催化作用下发生反应的化学方程式: . 若利用图2实验可进行定理分析,图中仪器A的名称为 , 实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是 .
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因: , H2O2初始物质的量浓度为(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:
在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5molL﹣1的硫酸,10s时收集到产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为molL﹣1s﹣1(假设反应前后溶液的体积不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜晶醇可用为消毒剂、抗氧化剂和溶剂,已知α﹣萜晶醇的结构简式如图所示,则下列说法错误的是( ) 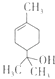
A.1mol该物质最多能和lmol氢气发生加成反应
B.该物质属于烃的衍生物
C.该物质能使溴水褪色
D.分子式为C10H20O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com