
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
分析 ①苯乙烯中含有1条碳碳双键;
②4乙烯和丙烯的最简式均为CH2,且结构中均C-H键为极性键;
③标况下,HF为液态;
④溶液越稀,NH4+的水解程度越大;
⑤NO2和N2O4的最简式均为NO2;
⑥KClO3+6HCl(浓)=KCl+3Cl2+3H2O反应转移5mol电子生成3mol氯气;
⑦1mol铁粉在1mol氯气中充分燃烧,铁过量;
⑧求出 Fe的物质的量,然后根据铁与足量水蒸气完全反应变为+$\frac{8}{3}$来分析.
解答 解:①苯环中不含碳碳双键,故苯乙烯中含有1条碳碳双键,即1mol苯乙烯中含NA条碳碳双键,故①错误;
②乙烯和丙烯的最简式均为CH2,故4.2g混合物中含有的CH2的物质的量为0.3mol,且结构中均C-H键为极性键,故0.3molCH2中含0.6NA条极性键,故②正确;
③标况下,HF为液态,故不能根据气体摩尔体积来计算其物质的量和含有的电子数,故③错误;
④溶液越稀,NH4+的水解程度越大,故1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目前者多,故④错误;
⑤NO2和N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为0.1mol,则含0.3NA个原子,故⑤正确;
⑥KClO3+6HCl(浓)=KCl+3Cl2+3H2O反应转移5mol电子生成3mol氯气,故当生成1mol氯气时转移$\frac{5}{3}$NA个电子,故⑥错误;
⑦1mol铁粉在1mol氯气中充分燃烧,铁过量,而氯气反应后变为-1价,故1mol氯气得2NA个电子,则铁失去2NA个电子,故⑦错误;
⑧16.8gFe的物质的量为0.3mol,而铁与足量水蒸气完全反应变为+$\frac{8}{3}$,故0.3mol铁转移0.8NA个电子,故⑧正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
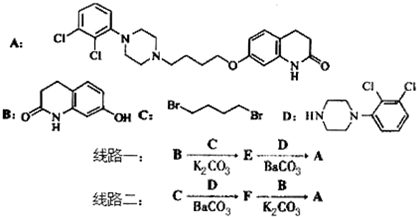
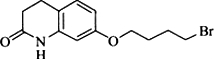 ,其含氧官能团有肽键、醚键(写名称).
,其含氧官能团有肽键、醚键(写名称).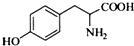 、
、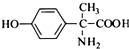 .
.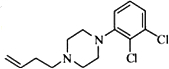 .
.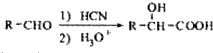 写出由C制备化合物
写出由C制备化合物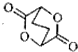
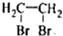
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的单质在氧气中燃烧生成Y2O | |
| B. | X、W的简单离子均能促进水的电离 | |
| C. | 原子半径由小到大的顺序为X<Y<Z<W | |
| D. | Z单质加入到Y的可溶性盐溶液中,可以置换出Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1mL 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2悬浊液,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol•L-1 NaOH溶液中加入几滴1mol•L-1 MgCl2溶液,生成白色沉淀,再加入几滴1mol•L-1 FeCl3溶液 |
| D | 硅酸胶体的制备 | 向Na2SiO3溶液(饱和溶液1:2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边振荡,至溶液红色变浅并接近消失 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾有效措施 | |
| C. | 绚丽缤纷彩色的烟花中添加了含钾、钠、铁、铜等金属化合物 | |
| D. | 使用该分子催化剂可将一次能源太阳能直接转化成二次能源,例如电能、氢能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
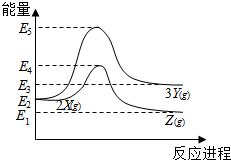
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H<0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com