
| 序号 | 实验目的 | 实验操作 |
| A | 测定某溶液的pH | 用玻璃棒蘸取该溶液点在pH试纸中间 |
| B | 加快锌与稀硫酸制取H2的速率 | 在稀硫酸中滴加少量CuSO4溶液 |
| C | 证明醋酸是弱电解质 | 将CH3COONa晶体加入水中,会促进水的电离平衡 |
| D | 制取无色AlCl3 | 加热蒸发AlCl3溶液 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| C、向明矾溶液中加入过量氢氧化钡溶液:Al3++2SO2-4+2Ba2++4OH-=2BaSO4↓+AlO-2+2H2O |
| D、等物质的量的NaHCO3和Ca(OH)2溶液混合:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在实验室里硅酸钠溶液存放在带橡胶塞的试剂瓶中 |
| B、提倡人们购物时不用塑料袋,是为了防止白色污染 |
| C、氟利昂(CCl2F2)因破坏大气臭氧层而导致“温室效应” |
| D、为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
查看答案和解析>>
科目:高中化学 来源: 题型:
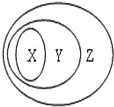 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )| 选项 | X | Y | Z |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 电解质 | 离子化合物 | 化合物 |
| C | 胶体 | 分散系 | 混合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com