
| A.镭的金属性比钙弱 | B.单质能与水反应生成H2 |
| C.镭在化合物中呈+2价 | D.碳酸镭难溶于水 |
科目:高中化学 来源:不详 题型:单选题
| A.上述三种元素的原子半径大小为Y<X<W |
| B.W、X、Y原子的核外最外层电子数的总和为10 |
| C.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| D.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X、Y、Z 3种元素组成的化合物中阴、阳离子所含电子数不等 |
| B.X与Z为同主族元素,它们的单质与W单质反应均失去电子 |
| C.Y、Z、W 3种元素组成的某种化合物可用于消毒 |
| D.Y与Z的单质在常温下反应生成Z2Y2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电负性:As>Cl>P | B.热稳定性:HCl>HBr>AsH3 |
| C.第一电离能:Br>Se>As | D.酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同种元素的原子均具有相同的质子数和中子数 |
| B.不同元素的原子构成的分子只含极性键 |
| C.第三周期中的非金属元素的气态氢化物还原性越强,对应元素的最高价含氧酸酸性越弱 |
| D.第ⅠA族和第ⅦA族元素从上到下随原子序数递增,单质的沸点均逐渐升高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B.基态碳原子的价电子排布图: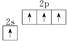 |
C.基态铜原子的价电子排布图: |
| D.Fe3+的最外层电子排布式为:3s23p63d5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.质子数c>d | B.离子的还原性Y2->Z- |
| C.氢化物的稳定性H2Y>HZ | D.原子半径X<W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子半径:Na+>N3->H+ |
| B.与水反应都是氧化还原反应 |
| C.与盐酸反应都只生成一种盐 |
| D.加热熔化时,都只破坏离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.152 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6、-2 | -1 | -1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com