
����Ŀ��������������Ӱ�����ǵ��������������е���������������������������������Ҫԭ��֮һ������������������������ж��ַ�����
(1)������Ԫ�طǽ����Խ�ǿ����________��
(2)NH3����ԭ��������(SCR)������ĿǰӦ����㷺���������������ѳ���������Ӧԭ����ͼ1��ʾ��

����ͼ1��֪SCR�����е�������Ϊ________��
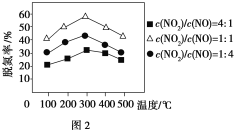
����Fe������ʱ���ڰ�������������£���ͬc(NO2)/c(NO)��Ӧ���ѵ�����ͼ2��ʾ���ѵ�Ч����ѵ�c(NO2)/c(NO)��________��
(3)��ˮ�������õ�����SO2�������������չ������£�
��SO2���ں�ˮ����H2SO3��H2SO3���ջ�����SO![]() ��SO
��SO![]() ���Ա���ˮ�е��ܽ�������ΪSO
���Ա���ˮ�е��ܽ�������ΪSO![]() ����ˮ��pH��________(����ߡ������䡱���͡�)��
����ˮ��pH��________(����ߡ������䡱���͡�)��
��SO2��O2��H2SO4��Һ�п��Թ���ԭ��أ��为����Ӧʽ��_____________________��
(4)��(Te)Ϊ�ڢ�A��Ԫ�أ��ǵ�����¼����²��ϵ���Ҫ�ɷ�֮һ����ҵ�Ͽɽ�SO2ͨ��TeCl4��������Һ�н��С���ԭ���õ��ڣ��÷�Ӧ�Ļ�ѧ����ʽ��___________________
________________________________________________________________________��
���𰸡�(1)O (2)��NO��NO2 ��1��1 (3)�ٽ��� ��SO2��2e����2H2O===SO![]() ��4H�� (4)TeCl4��2SO2��4H2O===Te��4HCl��2H2SO4
��4H�� (4)TeCl4��2SO2��4H2O===Te��4HCl��2H2SO4
��������(1)�ɵ�����Ԫ����Ԫ�����ڱ��е�λ��֪��Ԫ�صķǽ����Խ�ǿ��(2)����ͼ1֪���������еĵ�Ԫ�ؼ�̬���ͣ���NO��NO2��������������ͼ2֪����c(NO2)/c(NO)��1��1ʱ���ѵ�Ч����ѡ� (3)�ٵ������ᱻ����������ʱ������ת��Ϊǿ�ᣬ���º�ˮ��pH���͡��ڸ�����SO2ʧȥ����ת��ΪSO![]() ���ɴ˿�д����Ӧ�ĵ缫��Ӧʽ��
���ɴ˿�д����Ӧ�ĵ缫��Ӧʽ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����xR2++yH++O2=mR3++nH2O�����ӷ���ʽ�У���m��R3+�ж���ȷ���ǣ�������
A.m=4��R3+����������
B.m=2y��R3+����������
C.m=2��R3+�ǻ�ԭ����
D.m=y��R3+�ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֪O3����ΪV���νṹ��O3��ˮ�е��ܽ�Ⱥ�O2�Ƚ�
A.O3��ˮ�е��ܽ�Ⱥ�O2һ�� B.O3��ˮ�е��ܽ�ȱ�O2С
C.O3��ˮ�е��ܽ�ȱ�O2Ҫ�� D.û�취�Ƚ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʾ��ij���е���Ҫ������Ⱦ��ΪSO2��NOx��CO�ȣ�����Ҫ��ԴΪȼú��������β�������������о���
��1��Ϊ����ȼú��SO2���ŷţ��ɽ�úת��Ϊ���ȼ��ˮú����CO��H2����
��֪��![]() ��H��241.8kJ��mol��1��
��H��241.8kJ��mol��1��
![]() ��H����110.5kJmol��1
��H����110.5kJmol��1
д����̿��1molˮ������Ӧ����ˮú�����Ȼ�ѧ����ʽ��________��
��2������β����NO���ڷ��������������ɵģ���ӦΪN2��g����O2��g��![]() 2NO��g�� ��H��0��
2NO��g�� ��H��0��
������0.8molN2��0.2molO2�����ƿ�����ɣ��Ļ���������ij�ܱ������У�����1300����Ӧ�ﵽƽ�⣬�������8��10��4molNO��������¶��´˷�Ӧ�Ļ�ѧƽ�ⳣ��K��________������Ƽ���������
�������������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ����________��
��3��������ͼ��ʾװ�ã��缫��Ϊ���Ե缫��������SO2�������������ų�����Һ����NO2��

���缫A�ĵ缫��ӦʽΪ________��
�缫B�ĵ缫��ӦʽΪ________��
�����������£��������ų�����Һ����NO2��ʹ��ת��Ϊ�����壬ͬʱ����SO32�����÷�Ӧ�����ӷ���ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ��ϳ�������������£�

����ͼ��ѡ����ȡ����ĺ���װ�ã�

��1��װ��C������Ϊ_________________��ʵ����ͨ������װ��C�Ʊ�_________��
A��H2 B��H2S C��CO2 D��O2
��2��ʵ������װ��D�Ʊ�NH3�Ļ�ѧ����ʽΪ_______________________________��
��3������װ��B�Ʊ�SO2������ѡ���Լ�Ϊ___________��
A��Ũ���ᡢ�������ƹ��� B��Ũ���ᡢͭƬ
C��ϡ���ᡢ��������Һ D��Ũ���ᡢ��м
��4��SO2��O2ͨ����װ�ã���װ�õ����ó��˿��Կ���SO2��O2�������⣬������__________��

��5������һ������SO2(g)��O2(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ�õ����±��е��������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
����x=_______mol��y=_______mol��T1______T2���>������=����<��)
��6��SO2β������NaOH��Һ���գ��õ�Na2SO3��NaHSO3�����Ρ���һ�����ʵ�����SO2������������Һ��Ӧ��������Һ��Na2SO3��NaHSO3�����ʵ���֮��Ϊ2:3����μӷ�Ӧ��SO2��NaOH�����ʵ���֮��Ϊ________��
A. 5:7 B��1:2 C��9:4 D��9:13
��7�������백ˮ��Ӧ��������炙�������泥��ֳ�ȡ(NH4)2SO4��NH4HSO4�������Ʒ7.58 g�����뺬0.1 molNaOH����Һ��������Ӧ����OH-+H+��H2O, ��OH-+NH4+��NH3��+H2O����ַ�Ӧ������1792 mL����״��������֪�����ȷ�Ӧ������Ʒ��(NH4)2SO4�����ʵ���Ϊ_______mol��NH4HSO4�����ʵ���Ϊ_______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��AlCl3��Һ�������ɵõ��������Ȼ������� B. ǿ����ʶ�������ˮ������BaSO4���������
C. ǿ����Һһ����������Һ������ǿ D. �������Һ�ĵ�����̻ᷢ����ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص绯ѧԭ����˵���������ǣ� ��
A���Ȼ������۵���������ͣ���˹�ҵ����ò��õ�������Ȼ������Ʊ�������
B�����ʱ��ͨ���Ѵ��ƵĽ�����Ʒ���������ѶƲ����������
C������ұ�����ơ��ơ�þ�������������õĽ�������ⷨ������Ψһ���еĹ�ҵ����
D���Դ��ʹ�������ǽ��еġ���������������������������Ӧ����ԭ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. C ��N ��O�ĵ�һ��������������
B. NH3 ��H3O+��NH4+ ���������
C. P4�� CCl4�� CH4 ��Ϊ��������ṹ�����Ǿ�Ϊ109��28��
D.HClO �� HClO3 �� HClO4������������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�е�Cl�����ʵ���Ũ����100ml 1molL��1AlCl3��Һ��Cl��Ũ����ȵ��ǣ� ��
A.75ml 2molL��1�Ȼ�þ��Һ
B.150ml 1 molL��1�Ȼ�����Һ
C.50ml 3molL��1�Ȼ�����Һ
D.50ml 1 molL��1�Ȼ�����Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com