
【题目】亚硝酸钠(NaNO2)是一种工业盐,在生产、生活中应用广泛,外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组通过如下装置(夹持及加热装置略去)制取NaNO2样品并对样品含量进行测定
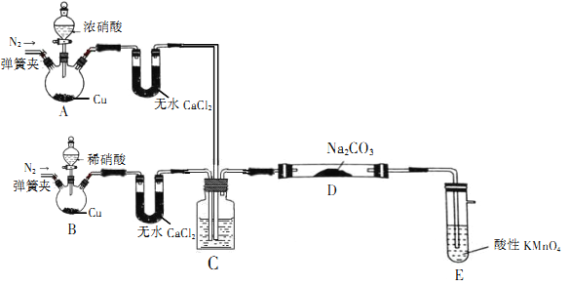
该小组先查阅资料知:NO、NO2能被酸性高锰酸钾氧化为NO3-。
(1)装置A中用于盛放浓硝酸的仪器名称为__________,装置D中发生的化学反应方程式为___________。
(2)①装置C中所装的液体需满足的条件是____________________。
②其作用为____________________。
(3)装置E的作用是____________________。
(4)为测定制得样品中NaNO2的含量,该实验中需配制KMnO4标准溶液并酸化,应选择__________(填化学式)来酸化KMnO4溶液。
(5)已知:在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定样品中亚硝酸钠的含量,该小组称取4.0g样品溶于水配制成250mL溶液,取25.00mL溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液进行滴定,消耗20.00mL酸性KMnO4溶液(杂质不反应)。滴定过程中酸性KMnO4溶液的作用是____________________,所得样品中NaNO2的质量分数为__________。
【答案】)分液漏斗 Na2CO3+NO2+NO=2NaNO2+CO2 既不能溶解NO2、NO,也不能与NO2、NO发生化学反应 通过观察广口瓶液体中产生气泡的速率来控制NO2、NO的混合比例 吸收过量的NO2、NO,避免尾气造成环境污染 H2SO4 做氧化剂和指示剂 86.25%
【解析】
(1) 装置A内铜和浓硝酸反应生成二氧化氮气体,装置B内铜和稀硝酸反应生成一氧化氮气体,两种气体与碳酸钠反应生成亚硝酸钠据此写出反应的方程式;
(2) 装置C的作用既可以使干燥一氧化氮、二氧化氮气体混合均匀,控制气体的流速,据此分析装置C中所装的液体需满足的条件及作用;
(3) 酸性高锰酸钾溶液能够把剩余的氮的氧化物吸收处理,以防止污染空气,据此分析装置E的作用;
(4) KMnO4溶液具有强氧化性,一般都用硫酸来酸化;
(5) NO2-可将MnO4-还原为Mn2+,体现了酸性KMnO4溶液的强氧化性,滴定终点的现象为滴入最后一滴酸性高锰酸钾溶液,溶液变成紫红色,且30s内颜色保持不变;所以高锰酸钾溶液除了起到氧化性的作用外,还能起到指示剂的作用;根据氧化还原反应中电子得失守恒关系:2MnO4-~5NO2-,计算出样品中含有亚硝酸钠的量及质量,最后计算出样品中NaNO2的质量分数。
(1) 控制液体的滴加速度,装置A中用于盛放浓硝酸的仪器为分液漏斗;装置A内铜和浓硝酸反应生成二氧化氮气体,装置B内铜和稀硝酸反应生成一氧化氮气体,两种气体与碳酸钠反应生成亚硝酸钠,反应的化学反应方程式为:Na2CO3+NO2+NO=2NaNO2+CO2 ;
综上所述,本题答案是:分液漏斗;Na2CO3+NO2+NO=2NaNO2+CO2 。
(2)①因为两个反应产生的NO2和NO最终要和碳酸钠反应,因此装置C中所装的液体需满足的条件是:既不能溶解NO2、NO,也不能与NO2、NO发生化学反应;
综上所述,本题答案是:既不能溶解NO2、NO,也不能与NO2、NO发生化学反应。
②该装置内所盛装的溶液除了使气体混合均匀,还可以通过观察C装置内液体中产生气泡的速率来控制NO2、NO的混合比例,以便NO2、NO混合气体尽可能与碳酸钠完全反应;
综上所述,本题答案是:通过观察广口瓶液体中产生气泡的速率来控制NO2、NO的混合比例 。
(3)根据信息可知,酸性高锰酸钾溶液能够把剩余的氮的氧化物吸收处理,以防止污染空气;因此装置E的作用是吸收过量的NO2、NO,避免尾气造成环境污染;
综上所述,本题答案是:吸收过量的NO2、NO,避免尾气造成环境污染。
(4) KMnO4溶液具有强氧化性,能够氧化盐酸,不能用盐酸酸化;而硝酸具有强氧化性,影响实验,稀硫酸性质稳定,不能被高锰酸钾溶液氧化;所以该实验中需配制KMnO4标准溶液并选择稀H2SO4来酸化。
综上所述,本题答案是:H2SO4。
(5) NO2-可将MnO4-还原为Mn2+,体现了酸性KMnO4溶液的强氧化性,滴定终点的现象为滴入最后一滴高锰酸钾溶液,溶液变成紫红色,且30s内颜色保持不变;以上利用了高锰酸钾的氧化性和做指示剂性质;消耗标准液的体积为20.00mL,25.00mL样品消耗高锰酸钾的物质的量为0.100mol·L-1×0.02 L=0.002mol;则250mL样品溶液会消耗高锰酸钾的物质的量为0.02 mol;根据化合价变化可得反应的关系式:2MnO4-~5NO2-,则4.0g样品中含有亚硝酸钠的物质的量为0.02mol×5/2=0.05 mol,质量为0.05×69=3.45g,所以所得样品中NaNO2的质量分数为3.45g/4.0g×100%=86.25%;
综上所述,本题答案是:做氧化剂和指示剂 ,86.25%。


科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。
资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂。
回答下列问题:
(1)水合肼的制备:有关反应原理为:NaClO + 2NH3 = N2H4·H2O + NaCl。
①用下图装置制取水合肼,其连接顺序为_________(按气流方向,用小写字母表示)。




②装置A的作用是_______。
③开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加NaClO溶液。滴加NaClO溶液时不能过快的理由___________。
(2)碘化钠的制备
ⅰ.向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ⅱ.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
ⅲ.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
ⅳ.将步骤ⅲ分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g。
④步骤ⅰ适宜采用的加热方法是水浴加热, 该步骤反应完全的现象是_________。步骤ⅱ中IO3-参与反应的离子方程式为________________________________。
⑤步骤ⅲ “将溶液与活性炭分离”的方法是趁热过滤。
⑥本次实验产率为__________。实验发现,水合肼实际用量比理论值偏高,可能的原因是___________。
⑦某同学检验产品NaI中是否混有NaIO3杂质。取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝。得出NaI中含有NaIO3杂质。请评价该实验结论的合理性____________。(若认为合理写出离子方程式,若认为不合理说明理由)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。H2O2能与SO2反应生成H2SO4, H2O2的分子结构如图所示。下列说法错误的是( )

A. H2O2的结构式为H—O—O—H
B. H2O2为含有极性键和非极性键的共价化合物
C. 与SO2在水溶液中反应的离子方程式为SO2+ H2O2=2H++SO42-
D. H2O2与SO2反应过程中有共价键断裂,同时有共价键和离子键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小粒金属钠投入到盛有冷水的小烧杯中,以下描述合理的是
A. 无明显现象 B. 烧杯内溶液颜色逐渐变红
C. 金属钠浮于液面上,四处游动 D. 金属钠沉入烧杯底部,并产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
 △H=+88.62 kJ/mol
△H=+88.62 kJ/mol
以下叙述错误的是________(填序号)
a.NBD的能量比Q的能量高 b.NBD和Q互为同分异构体
c.NBD的分子式为C7H8 d.NBD能使溴水褪色
e. NBD及Q的一氯代物均为三种
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是______。

a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:

①在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是_____(填实验序号)。
②对锌和稀硫酸反应,实验1和2表明,____对反应速率有影响,实验1和3表明,____对反应速率有影响
③进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。在OA、AB、BC三段中反应速率最快的是_______,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疔等领域都有着重要的应用。请回答下列问题:
(1)基态Ti原子的价电子轨道表示式为___________。
(2)化学式为[Ti(H2O)6]Cl3的绿色晶体是TiCl3的六水合物的一种晶型,该晶体中,与Ti3+形成配位键的原子是___________ (填元素符号),该原子的杂化类型为___________杂化,该晶体所含元素中,电负性最大的元素是___________ (填元素符号)。
(3)化学式为[Ti(H2O)5 Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1mol该晶体溶于水配成500mL溶液,加入足量AgNO3溶液使Cl-完全沉淀,消耗AgNO3的物质的量为___________mol。
(4)钛与卤素形成的化合物的熔沸点如下表所示,

TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是______________________。
(5)TiO2能溶浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如下图所示,阳离子化学式为___________,写出一种与SO42-互为等电子体的分子___________。

(6)下图是钛晶体在空间的一种堆积方式,此堆积方式名称为___________,钛原子的配位数为__________。已知:a=0.295nm,c=0.469nm,则该钛晶体的密度为___________g·cm-3(NA表示阿伏加德罗常数的值,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于非氧化还原反应的是
A. 2H2O2![]() 2H2O +O2↑B. Cl2+H2O
2H2O +O2↑B. Cl2+H2O![]() HCl+HClO
HCl+HClO
C. SO2 + 2NaOH=Na2SO3 + H2OD. C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据你对金属钠性质的了解,回答下列问题:
(1)关于钠的叙述中,正确的是________(填字母)。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的______、________等物质反应,通常将它保存在_______里。
(3)将一小块钠投入到下列溶液中,既能产生气体又会出现白色沉淀的是________(填字母)。
A.稀硫酸 B.硫酸铜溶液
C.氢氧化钠溶液 D.氯化镁溶液
(4)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。

①列出计算钠相对原子质量的数学表达式______________(用含有a、b、c的算式表示)。
②无水氯化钙的作用是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com