
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.3×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
分析 (1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数确定酸性强弱;
(2)溶液中c(CH3COO-)=c(H+)=camo/L,根据电离平衡常数KCH3COOH=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$进行计算即可.
解答 解:(1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,酸性最强的是H2PO4-,最弱的是HPO42-,
故答案为:H2PO4-;HPO42-;
(2)25℃时,c mol/L的CH3COOH的电离转化率为a,溶液中c(CH3COO-)=c(H+)=camo/L,
则该温度下醋酸的电离平衡常数为:KCH3COOH=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{ca×ca}{c-ca}$=$\frac{c{a}^{2}}{1-a}$,
故答案为:$\frac{c{a}^{2}}{1-a}$.
点评 本题考查了弱电解质的电离及其影响,题目难度中等,明确酸的电离平衡常数与酸性强弱的关系是解本题关键,注意掌握电离平衡常数的概念及表达式,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LH2O所含分子数为0.5NA | |
| B. | 1mol•L-1CaCl2溶液中所含Ca2+离子的数目为NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 0.1molZn与含0.1molHCl的盐酸溶液充分反应,转移电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O | B. | 硫酸 | C. | NaOH(s) | D. | Na2SO4(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电源的负极就是阴极 | |
| B. | 与直流电源正极相连的是电解池的阴极 | |
| C. | 与直流电源负极相连的电极上发生还原反应 | |
| D. | 阳极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
用Cl2生产某些含氯有机物时会产生副产物HC1。利用 反应A,可实现氯的循环利用。
反应A,可实现氯的循环利用。
反应A:4HCl+O22Cl2+2H2O
(1)已知:Ⅰ、反应A中, 4mol HCl被氧化,放出115.6kJ的热量。
4mol HCl被氧化,放出115.6kJ的热量。
Ⅱ、
①反应A的热化学方程式是________________________。
②断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中H—0 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)合成氨工厂常通过测定反应前后混合气体的密度来确定氨的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况)。该合成氨厂N2的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
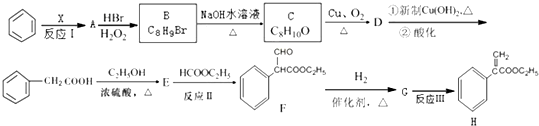
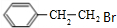 ;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基.
;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基. .
.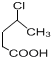 制备
制备 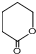 的合成路线流程
的合成路线流程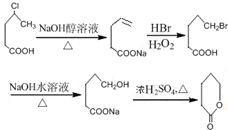 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

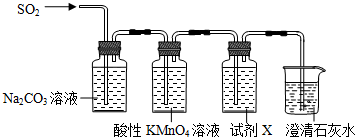
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | Q1=Q2 | C. | 2Q1>Q2 | D. | Q2=Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
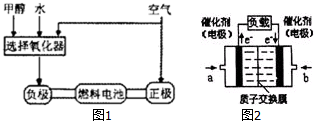
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com