
 浓度均为0.1mol•L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg$\frac{v}{{v}_{0}}$的变化关系如图所示.下列叙述正确的是( )
浓度均为0.1mol•L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg$\frac{v}{{v}_{0}}$的变化关系如图所示.下列叙述正确的是( )| A. | 常温下,由水电离出的c(H+)•c(OH -):a<b | |
| B. | HX、HY都是弱酸,且HX的酸性比HY的弱 | |
| C. | 相同温度下,电离常数K( HX):a>b | |
| D. | lg$\frac{v}{{v}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$减小 |
分析 A.酸或碱抑制水电离,酸中氢离子浓度越小其抑制水电离程度越小;
B.根据图知,lg$\frac{V}{{V}_{0}}$=0时,HX的pH>1,说明HX部分电离为弱电解质,HY的pH=1,说明HY完全电离,为强电解质;
C.相同温度下,酸的电离平衡常数不变;
D.lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),n(X-)增大,n(Y-)不变,二者溶液体积相等.
解答 解:A.酸或碱抑制水电离,酸中氢离子浓度越小其抑制水电离程度越小,根据图知,b溶液中氢离子浓度小于a,则水电离程度a<b,所以由水电离出的c(H+)•c(OH-):a<b,故A正确;
B.根据图知,lg$\frac{V}{{V}_{0}}$=0时,HX的pH>1,说明HX部分电离为弱电解质,HY的pH=1,说明HY完全电离,为强电解质,HY的酸性大于HX,故B错误;
C.酸的电离平衡常数只与温度有关,所以相同温度下,电离常数K( HX):a=b,故C错误;
D.lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),n(X-)增大,n(Y-)不变,二者溶液体积相等,所以$\frac{\frac{n({X}^{-})}{V}}{\frac{n({Y}^{-})}{V}}$=$\frac{c({X}^{-})}{c({Y}^{-})}$变大,故D错误;
故选A.
点评 本题考查弱电解质电离,为高频考点,侧重考查学生分析推断及识图能力,正确判断两种酸的强弱是解本题关键,注意:酸的电离平衡常数只与温度有关,与溶液浓度无关,易错选项是D,题目难度中等.


科目:高中化学 来源: 题型:选择题
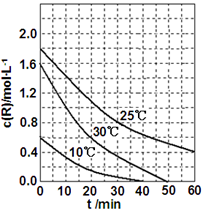 为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )
为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )| A. | 25℃时,在10~30min内,R 的分解平均速率为0.030 mol•L-1•min-1 | |
| B. | 对比30℃和10℃曲线,在50min时,R的分解百分率相等 | |
| C. | 对比30℃和25℃曲线,在0~50min内,能说明R的分解平均速率随温度升高而增大 | |
| D. | 对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| B. | c(A-)+c(HA)=2c (Na+)=0.4 mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与上述混合溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2 c (H+)-c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )| A. | HX、HY均为弱酸 | |
| B. | a点由水电离出的c(H+)=1.0×l0-13mol•L-l | |
| C. | c点溶液中:c(Y-)<c(Na+)<c(HY) | |
| D. | b点时,溶液的pH=7,酸碱恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和CO | B. | CO2和N2O | C. | O3和CO2 | D. | CO32-和NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用.已知POH=-lgc(OH-),经测定25℃时各组分含量随POH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用.已知POH=-lgc(OH-),经测定25℃时各组分含量随POH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | PH=7时,溶液中含氯微粒的浓度大小:c(ClO2-)>c(HClO2)>c (ClO2) | |
| C. | HClO2的电离平衡常数的数值Ka=10-6 | |
| D. | 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有2c(HClO2)+c(H+)=2c(ClO2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 烧瓶中的溶液呈红色,则原气体一定是SO2 | |
| B. | 烧瓶中的溶液呈蓝色,则原气体可能是NH3 | |
| C. | 形成喷泉的原因是烧瓶内压强大于外界大气压 | |
| D. | 若将石蕊改成氢氧化钠,则CO、CO2均能形成喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实 验 步 骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的10mL 0.5mol/L BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体. | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的10mL 0.5mol/L Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体. | 白色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com