
| A. | 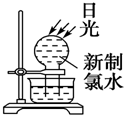 | B. |  | ||
| C. | 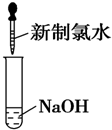 | D. | 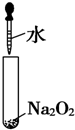 |
分析 A.光照条件下次氯酸分解生成氧气;
B.氯水呈酸性,与碳酸氢钠反应生成二氧化碳气体;
C.氯水与氢氧化钠溶液反应生成次氯酸钠和氯化钠,不会生成气体;
D.过氧化钠与水反应生成氢氧化钠和氧气.
解答 解:A.新制的氯水中含有次氯酸,光照条件下次氯酸分解生成氧气,故A错误;
B.新制的氯水呈酸性,碳酸氢钠与氯水反应生成二氧化碳气体,故B错误;
C.氯水与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,不会生成气体,故C正确;
D.过氧化钠与水反应生成氧气,故D错误;
故选C.
点评 本题考查了实验方案的评价,题目难度中等,明确常见元素及其化合物性质为解答关键,注意明确新制氯水的组成,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | “三聚氰胺”奶粉事件是化学问题,不是商家的道德问题 | |
| B. | 爆炸一定是化学变化 | |
| C. | 某国产化妆品的生产不使用任何化学原理和方法 | |
| D. | 我们学习化学学科,应该做到:准确理解、辩证看待以及正面传播它 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{576v}$mol/L | B. | $\frac{125a}{36v}$mol/L | C. | $\frac{250a}{36v}$mol/L | D. | $\frac{250a}{48v}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象 |
| Ⅰ | 向2 mL 0.1 mol/LFeCl2溶液中滴加KSCN溶液,再滴加氯水 | |
| Ⅱ | 向2 mL 0.1 mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol/L KI溶液 | 滴加KSCN溶液后,溶液变成红色; 滴加KI溶液后,红色无明显变化 |
| 编号 | 操作 | 现象 |
| Ⅲ | 向2 mL 0.1 mol/L KI溶液中滴加1 mL 0.1 mol/L FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色; 滴加KSCN溶液后,溶液变成红色 |
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2 mL 0.1 mol/L KI溶液中滴加 1 mL 0.1mol/L FeCl3溶液,或CCl4;或铁氰化钾溶液 | 溶液变蓝(或溶液分层,下层溶液为紫色;或生成蓝色沉淀),结论:Fe3+能与I-发生氧化还原反应,生成I2(或Fe2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
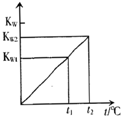 水的离子积常数KW与温度t(℃)的关系如图所示:
水的离子积常数KW与温度t(℃)的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
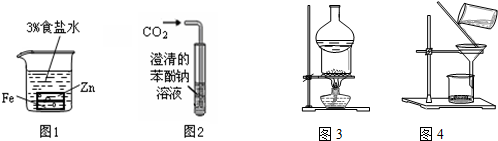
| A. | 图1中正极反应是Zn-2e-=Zn2+ | |
| B. | 图2可用于比较碳酸、苯酚酸性的强弱 | |
| C. | 图3可用于I2与NH4Cl混合物的分离 | |
| D. | 图4用于去除Fe(OH)3胶体中含有的可溶性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
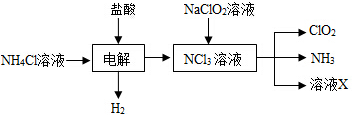
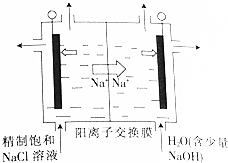
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com