
| A. | 苯的硝化、乙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 | |
| B. | 蛋白质、淀粉、油脂等都能在人体内水解并提供能量 | |
| C. | 乙烯、苯、乙烷分子中的所有原子都在同一平面上 | |
| D. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
分析 A.乙烯被酸性高锰酸钾氧化;
B.蛋白质、淀粉、油脂等都能在人体内都可以水解并提供能量;
C.乙烷为饱和烃,具有甲烷的结构特点;
D.石油裂化是将重油转化为轻质油,裂解是得到小分子的烯烃等.
解答 解:A.乙烯含有碳碳双键,被酸性高锰酸钾氧化,属于氧化反应,故A错误;
B.蛋白质、淀粉、油脂等都能在人体内水解并提供能量,故B正确;
C.乙烷为饱和烃,具有甲烷的结构特点,则原子不可能在同一个平面上,故C错误;
D.石油催化裂化的目的是提高汽油等轻质油的产量与质量,裂解的目的是得到小分子的烯烃,如乙烯、丙烯等气态短链烃,故D错误.
故选B.
点评 本题考查有机物的性质、原子共面、石油的炼制等知识点,易错选项是D,注意两者的区别.


科目:高中化学 来源: 题型:多选题
| A. | 51% | B. | 56% | C. | 49% | D. | 10% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中方程的热量可计算中和热,回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中方程的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:R<Y<Z | B. | 简单氢化物的热稳定性:R>Y | ||
| C. | R与Y只能形成一种化合物 | D. | 最高价氧化物的水化物酸性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为反应物浓度越大,反应速率越快,所以常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 | |
| B. | 增大反应物浓度可加快反应速度,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| C. | 对化学反应速率起决定性作用的因素是参加反应的各物质的性质 | |
| D. | 化学反应速率也可以用单位时间内固体物质的消耗量或者气体物质的生成量来表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
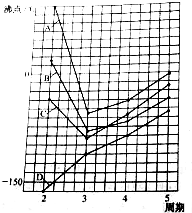 图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.
图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
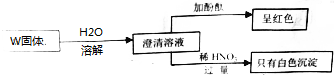
| A. | 一定不存在③⑥ | B. | 可能存在①② | C. | 一定存在①④⑦ | D. | 至少存在④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
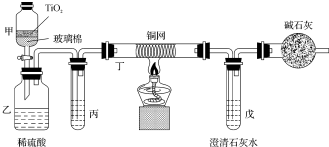
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com