
| A、0.1mol?L-1某二元弱酸酸式盐NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| B、向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、0.1 mol?L-1的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
| D、25℃时,pH=9.4、浓度相同的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) |


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
| A、1:10:100:1 000 |
| B、0:1:12:11 |
| C、14:13:12:11 |
| D、14:13:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能(kJ/mol) | 386 | 167 | 498 | 946 | 460 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被还原 |
| D、放电时正极附近溶液的酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
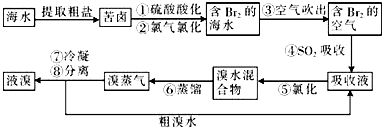
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物的稳定性:B<E |
| B、最高价氧化物对应的水化物碱性:C<D |
| C、简单离子半径:E<D |
| D、均含有A,B,C,E四种元素形成的两种化合物可以相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com