
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是()
A.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后混合后,溶液的pH=7,则反应后的混合后,2c(R2-)+c(HR-)=c(Na+)
B.0.05mol/L的CH3COOH溶液中加入等体积的0.05mol/L的KOH溶液,则:c(CH3COOH)+c(H+)=c(OH-)
C.pH=5的CH3COOH溶液和pH=5NH4Cl溶液中c(H+)相等
D.0.2mol/L NH4Cl和0.1mol/L NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
D
【解析】
试题分析:A.根据电荷守恒可得:2c(R2-)+c(HR-)+c(OH-)=c(H+)+c(Na+),由于溶液显中性,所以c(OH-)=c(H+),两式相减可得2c(R2-)+c(HR-)=c(Na+),正确;B. 0.05mol/L的CH3COOH溶液中加入等体积的0.05mol/L的KOH溶液,二者恰好完全反应产生盐CH3COOK.由于该盐是强酸弱碱盐,醋酸根离子发生水解反应消耗水电离产生的H+,使溶液显碱性则根据质子守恒可得:c(CH3COOH)+c(H+)=c(OH-),正确;C.由于溶液的pH 相等,所以溶液中c(H+)相等,正确;D. 0.2mol/L NH4Cl和0.1mol/L NaOH溶液等体积混合,二者会发生反应:NH4Cl+ NaOH=NaCl+NH3·H2O。根据物质的量的关系可知得到的是NaCl、NH3·H2O、NH4Cl等物质的量浓度的混合溶液。由于NH3·H2O的电离作用大于NH4+的水解作用,所以c(NH4+)>c(Cl-)>c(Na+),c(OH-)>c(H+);盐的电离作用远大于水的电离作用,所以c(Na+)>c(OH-)。因此混合后溶液中离子浓度大小关系是:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+),正确。
考点:考查溶液中离子浓度的大小关系的知识。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中能大量共存的是
A.在80℃ pH= 10的溶液中:Na+ 、CH3CHO、Ag(NH3)2+ 、NO3—
B.溶液中能大量共存,通入CO2后仍能大量共存:K+、Ca2+ 、Cl—、NO3—
C.与镁反应只产生氢气的溶液中:NO3—、Cl—、H+、A13+
D.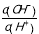 =1.0×10-12溶液中:C6H5O—、K+、SO42—、CH3COO—
=1.0×10-12溶液中:C6H5O—、K+、SO42—、CH3COO—
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三年级第二次月考理综化学试卷(解析版) 题型:选择题
下列各项反应对应的图像错误的是
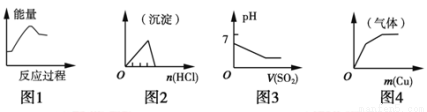
A.图1:将饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体
B.图2:将稀盐酸逐滴加入一定量偏铝酸钠溶液中
C.图3:将二氧化硫逐渐通入一定量氯水中
D.图4:将铜粉逐渐加入一定量浓硝酸中
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:实验题
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
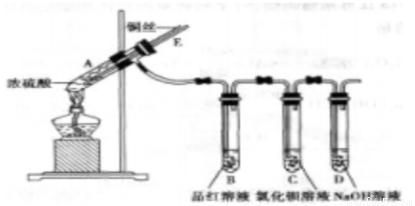
实验步骤:
①先连接好装置,检查气密性,再加入试剂;
②加热A试管,B中品红溶液褪色,熄灭酒精灯;
③将铜丝向上抽动离开液面。
(1)试管中发生反应的化学方程式为_____________________________.
(2)能够证明铜与浓硫酸反应生成气体的现象_________________________.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其分成两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 | __________ | ______________ |
写出其中SO2显示还原性的反应的离子方程式___________________.
(4)实验完毕后,先熄灭酒精灯,由于导管E存在,B中的液体不会倒吸入A中,其原因是___________________________________________.
(5)实验完毕后,装置中残留气体有毒,不能打开胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是_______________________.
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列关于有机物的说法不正确的是()
A.某甲酸溶液中可能存在着甲醛,加入新制的Cu(OH)2加热,有砖红色沉淀产生,证明一定存在甲醛
B.有机物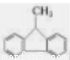 的所有碳原子可能处在同一平面上
的所有碳原子可能处在同一平面上
C.C6H14有多种同分异构体,其同分异构体中沸点最高的分子的一氯取代物有3种
D.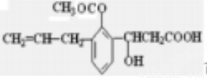 可发生取代、加成、消去、水解、氧化、加聚、缩聚反应
可发生取代、加成、消去、水解、氧化、加聚、缩聚反应
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列关于氧化性、还原性的判断正确的是()
A.B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强
B.发生氧化还原反应时,A原子失去的电子比B原子多,证明A的金属性一定比B强
C.适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2=2FeCl3+4FeI3
D.一定量氯气通入30mL10.00mol·L-1的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则0.15<n<0.25
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列说法正确的是()
A.NaF、MgO、AlCl3均由活泼金属和活泼非金属作用形成,都是离子化合物
B.CaCl2、NaOH、HCl、HD四种物质均属于化合物
C.某溶液中含有NH4+、SO32-、NO3-、SO42-离子加入适量过氧化钠,加热,搅拌,冷却后,不考虑溶液体积变化,保持浓度不变的离子有NO3-、SO42-
D.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者作用原理不同
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:填空题
(16分)碳及其化合物有广泛的用途。
(1) 将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2) 已知:C(s)+CO2(g)  2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)  CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
(3) CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g) =CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为_______________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4) 将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)  CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | CO | H2 | CO |
| |
900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)________________________。
(5) 工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
请回答下列问题:①与实验Ⅰ比较,实验Ⅱ改变的条件为____________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
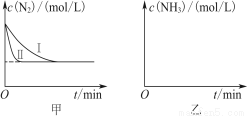
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知C(s)+H2O(g)═ CO(g)+H2(g) △H=akJ?mol﹣1
2C(s)+O2(g)═ 2CO(g) △H=﹣220kJ?mol﹣1
H﹣H、O=O和O﹣H键的键能分别为436、496和462kJ?mol﹣1,则a为
A.﹣332 B.﹣118 C.+350 D.+130
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com