
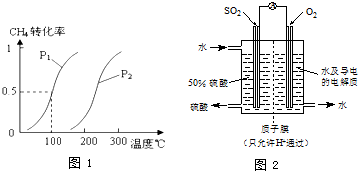
| ||
| 5min |
| 0.005×0.0153 |
| 0.005×0.015 |
| 0.018 |
| 2 |
| 0.02 |
| 2 |
| 1.8×10-10 |
| 0.001 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①②③ | B、②③④ |
| C、①②④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 “问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题:
“问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题: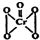 ,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为
,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为查看答案和解析>>
科目:高中化学 来源: 题型:
 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、应准确称取NaOH固体19.2g |
| B、定容时仰视读数,所配制的溶液的浓度会偏低 |
| C、为了减少损失,将氢氧化钠固体直接倒入容量瓶,加水溶解 |
| D、摇匀后溶液液面低于刻度线,应补充适量蒸馏水至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com