
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的平衡浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A、2c1<c3 |
| B、a+b=92.4 |
| C、a1+a3<1 |
| D、p3>2p2=2p1 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:

| A、YO2能使紫色石蕊试液先变红后褪色 |
| B、将W的氧化物溶于水可得W的含氧酸 |
| C、X的氢化物沸点比W的氢化物的沸点高 |
| D、Y的阴离子电子层结构与Z原子的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1的干燥烧瓶中盛有CO2,烧杯和滴管内盛有饱和NaHCO3溶液,挤压胶管的胶头会形成无色喷泉 |
| B、图2中若X为碳棒,开关K置于N处,铁极的反应:Fe-2e-═Fe2+ |
| C、图3中装置(Ⅰ)为一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红,则电极B发生了还原反应 |
| D、用图4验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液跟稀盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| B、碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、饱和石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| D、氯化铁溶液中加入过量的铁粉:Fe3++Fe=Fe 2+ |
| E、向稀氨水中加入稀盐酸:NH3?H2O+H+=NH4++H2O |
| F、小苏打溶液个烧碱溶液反应:HCO3-+OH-=CO32-+H2O |
| G、氢氧化钡溶液与稀硫酸反应:Ba2++OH-+H++SO42-═H2O+BaSO4↓ |
| H、铁和稀硫酸反应:2Fe+3H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
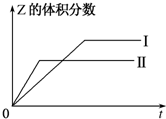 (1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:
(1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | 0族 | ||||||
| 一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 二 | ② | ③ | ||||||
| 三 | ④ | ⑤ | ⑥ | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作时,应使混合物中的水分完全蒸干后再停止加热 |
| B、蒸馏时,温度计水银球需靠近蒸馏烧瓶支管口,冷凝水的流向需从冷凝管的上口进下口流出 |
| C、过滤后洗涤沉淀时,应将固体转移至烧杯中,并加入适量蒸馏水充分搅拌后再过滤 |
| D、分液时,先从分液漏斗下口放出下层液体,更换烧杯后再从上口放出上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
| B、某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝的气体,说明原溶液中一定存在NH4+ |
| C、某溶液加入BaCl2溶液,产生了白色沉淀,再加入足量的HNO3溶液,沉淀不溶解,则溶液中一定含有SO42- |
| D、验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银的硝酸溶液,有白色沉淀出现,证明含Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A物质与B物质的反应速率之比为1:2 |
| B、单位时间内消耗a mol A,同时消耗3a mol C |
| C、容器内的压强不再变化 |
| D、混合气体的物质的量不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com