
【题目】对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(图中B1和B2、C1和C2分别互为同分异构体,无机产物略去):
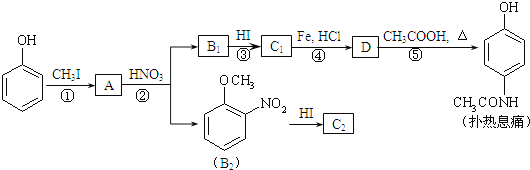
已知:![]() ,请按要求填空:
,请按要求填空:
⑴写出A分子中官能团名称:_________;C1的结构简式为:________________。
⑵写出由D生成扑热息痛的化学方程式:_______________________。
⑶写出反应③和④的反应类型:③______________,④__________。
⑷工业上设计反应①、②、③,而不是只通过反应②得到C1、C2,其目的是:______________________。
⑸扑热息痛有很多同分异构体,符合下列要求的同分异构体有5种:(I)是对位二取代苯;(II)苯环上两个取代基一个含氮不含碳、另一个含碳不含氮;(III)两个氧原子与同一原子相连。其中2种的结构简式是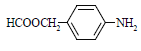 和
和![]() ,写出另3种同分异构体的结构简式____________、____________、____________。
,写出另3种同分异构体的结构简式____________、____________、____________。
【答案】醚键![]()
 取代反应还原反应保护酚羟基不被硝酸氧化
取代反应还原反应保护酚羟基不被硝酸氧化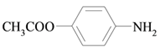


【解析】(1)苯酚和CH3I发生取代反应生成A: ,A分子中官能团名称为醚键,与硝酸发生硝化反应生成
,A分子中官能团名称为醚键,与硝酸发生硝化反应生成 或
或![]() ,所以B1为
,所以B1为![]() ,与HI发生取代反应,则C1为
,与HI发生取代反应,则C1为![]() ;
;
(2)C1为![]() ,C1发生还原反应得D为
,C1发生还原反应得D为![]() ,D与乙酸发生取代反应得扑热息痛,化学方程式为:
,D与乙酸发生取代反应得扑热息痛,化学方程式为: ;
;
(3)B1为![]() ,与HI发生取代反应,化学方程式为:
,与HI发生取代反应,化学方程式为:![]() +HI→
+HI→![]() +CH3I,根据信息R-NO2
+CH3I,根据信息R-NO2![]() R-NH2
R-NH2
可知,C1发生还原反应得D为![]() ,化学方程式为:
,化学方程式为:![]()
![]()
![]() ;
;
(4)C1、C2含有酚羟基,易被硝酸氧化,应先生成醚基,防止被氧化;
(5)含N基团可为氨基或硝基,当为氨基时,含碳基团可为羧基或酯基,当为硝基时,对位应为乙基,对位二取代苯,苯环上两个取代基一个含氮不含碳、另一个含碳不含氮;两个氧原子与同一原子相连,可能的结构还有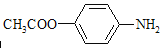 、
、![]() 、
、![]() 。
。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】工业上“中温焙烧——钠化氧化法”回收电镀污泥中的铬已获技术上的突破。其工艺流程如下:
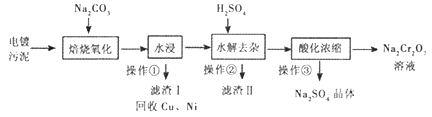
【查阅资料】
①电镀污泥中含有Cr(OH)3、Al203、ZnO、CuO、NiO等物质;水浸后溶液中含有Na2CrO4、NaAlO2、Na2ZnO2等物质;
②Na2CrO4转化成Na2Cr2O7离子反应方程式为:2 CrO42-+2H+=Cr2O72-+H2O;③Na2SO4、Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表:

请回答:
(1)操作①的名称是_______,“水浸”后的溶液呈_______性;
(2)“焙烧氧化”过程中Cr(OH)3转化成Na2CrO4的化学方程式为___________;
(3)滤渣II的主要成分有Zn(OH)2和X,生成X的离子反应方程式__________;
(4)“酸化浓缩”时,需继续加入H2SO4,然后_______、结晶、过滤。继续加入H2SO4目的是__________;
(5)以铬酸钠为原料,电化学法制备重铬酸钠的实验装置如图所示。
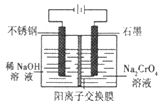
①阴极发生的电极反应式为:_____________;
②若测定阳极液中Na与Cr的物质的量之比值为d,则此时铬酸钠的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】任何一个化学反应中都会伴随能量变化和物质变化。
(1)下图为氢气和氧气生成1mol水蒸气时的能量变化情况。
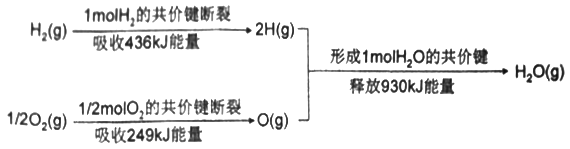
生成1mol水蒸气时,形成新化学键所释放的总能量_____断开旧化学键所吸收的总能量(填“大于”“小于”或“等于”),因此水的分解反应为________(填“吸热”或“放热”)反应。
(2)随着科学技术的发展和社会进步,各种各样的电器不断进入现代社会,化学电源大大丰富和方便了我们的生活、学习和工作。原电池中发生的化学反应属于______。镁铝原电池,电解质用稀硫酸,则其负极的电极反应式为______;电解质用氢氧化钠溶液,电池工作时,溶液中的OH-移向_____极(“镁”或“铝”)。
(3)在三个容器均为2L的密闭容器中发生反应:2HI(g) ![]() H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量(mol)随反应时间(min)的变化情况如下表所示,表中温度的单位为摄氏度(℃)。
H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量(mol)随反应时间(min)的变化情况如下表所示,表中温度的单位为摄氏度(℃)。
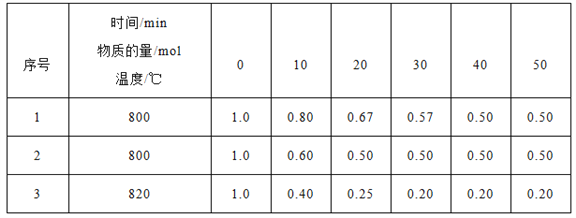
①实验1和实验2中,有一个实验使用了催化剂,则使用了催化剂的是实验_____(填“1”或“2”)。
②实验1中,20min~30min间生成I2(g)的平均反应速率为_____,实验3的反应达到化学反应限度时H2(g)物质的量的百分数为_______。
③下列物理量不再变化时,能判断实验3中反应达到化学反应限度的是__________。
A.混合气体颜色 B.混合气体密度 C.混合气体总压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol -1
2SO3(g) ΔH=-196.6 kJ·mol -1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K= 。
(2)下图是一种用NH3脱除烟气中NO的原理。
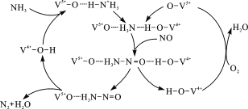
①该脱硝原理中,NO最终转化为H2O和_____________(填化学式)。
②当消耗1 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为__________L。
(3)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如右图所示,写出NO分解的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
A.a mL B.(50﹣a)mL C.大于(50﹣a)mL D.大于a mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在常温常压下:
①CH3CH2OH(l)+3O2(g)![]() 2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3=-44kJ·mol-1
④CH3CH2OH(l)+2O2(g)![]() 2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
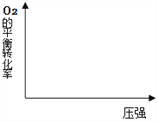
则 CO的燃烧热 ΔH =_________。
在图中画出,不同温度下(T1>T2),上述反应④中O2的平衡转化率随压强变化的关系图(请在图上标注温度T1、T2)。_________
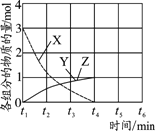
(3)一定条件下,在体积为3 L的密闭容器中反应CO(g) + 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
①反应的平衡常数表达式K=__________;根据下图,升高温度,K值将___________(填“增大”、“减小”或“不变”)。

②500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是________。
③X点与Y点的平均速率:v(X)_________v(Y);其中X点的正反应速率v正(X)与Z点的逆反应速率v逆(Z)的大小关系为v正(X)________v逆(Z)(填“>”、“<”、“=”)。
④300℃时能够说明该可逆反应达到化学平衡状态的标志是____________ (填字母)。
a.v生成(CH3OH) = v生成(H2) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度相等
⑤500℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是___________。(填字母)
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的百分含量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离提纯所选用的试剂正确的是
A.除去O2中混有的N2:选用灼热的铜网
B.提取碘水中的碘单质:选用有机试剂苯
C.除去CO2中混有的CO:选用适量澄清石灰水
D.除去Mg粉中混有的MgO:选用过量稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )。
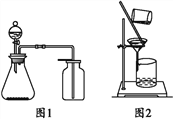
A. 选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2
B. 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸
C. 洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
D. 图2装置可用于分离乙酸和苯的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com