
| A. | 决定元素种类的是--电子数 | |
| B. | 决定元素化学性质的是--原子的核外电子数 | |
| C. | 决定元素相对原子质量的是--中子数 | |
| D. | 决定元素周期表中原子序数的是--核电荷数 |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:多选题
| 选 项 | 操作 | 现象 | 结论 |
| A | 向稀的苯酚水溶液中滴加浓溴水 | 生成白色沉淀 | 产物三溴苯酚不溶于水 |
| B | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生红色沉淀 | 淀粉水解可生成葡萄糖 |
| C | 溴乙烷和氢氧化钠溶液充分反应后,用足量稀硝酸酸化,再加入硝酸银溶液 | 生成淡黄色沉淀 | 溴乙烷中含有溴元素 |
| D | 将溴水加入苯中并充分振荡 | 溴水褪色 | 苯与溴发生了取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
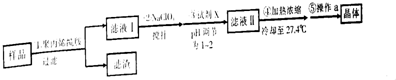
| A. | 步骤①中过滤操作需用到的玻璃仪器为玻璃棒、分液漏斗、烧杯 | |
| B. | 步骤②中搅拌操作可加快散热,减少FeCl3水解 | |
| C. | 步骤③中加入的试剂X为浓盐酸 | |
| D. | 步骤⑤中操作a为过滤、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子里碳氢原子的个数比为1:2 | |
| B. | 丙烯完全燃烧生成的CO2和H2O的物质的量相等 | |
| C. | 丙烯能使酸性KMnO4溶液褪色 | |
| D. | 丙烯易与溴水发生加成反应,且1 mol乙烯完全加成需消耗1 mol溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
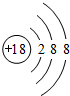 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 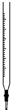 图为碱式滴定管,可盛装NaOH、KMnO4等溶液,不可盛装酸性液体 | |
| B. | 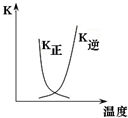 图中曲线表示反应2A(g)+B(g)═2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 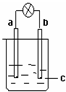 图中如果a是铁,b是碳,c是氯化铜溶液,则电流计指针偏转,且a变粗,b变细 | |
| D. | 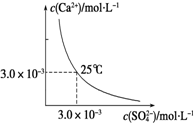 图表示25℃时,CaSO4在水中的沉淀溶解平衡曲线.向100 mL该条件下的CaSO4饱和溶液中加入100 mL 0.01mol•L-1的Na2SO4溶液有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是氧化剂 | B. | 是还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
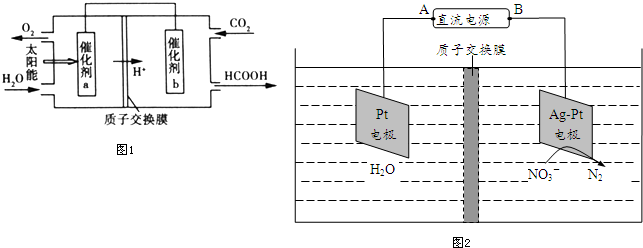
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com