
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
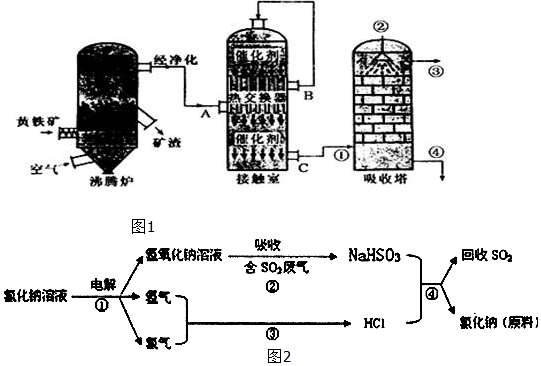
分析 (1)黄铁矿的主要成分是FeS2,在沸腾炉中高温条件下与氧气反应;
(2)吸收塔中吸收液的选择从实际吸收效果考虑不采用水而采用浓硫酸,可防止产生酸雾;
(3)由表中数据分析出温度和CuSO4的质量分数之间的关系,而CuSO4的质量取决于SO3 的质量,再由反应2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g),△H=-98.3kJ•mol-1分析SO3 的质量和温度之间的关系;
(4)依据流程图分析,电解氯化钠溶液得到氢气、氯气、氢氧化钠溶液,步骤③反应条件为点燃,为氯气和氢气反应生成W为HCl,步骤②X溶液和二氧化硫反应生成亚硫酸氢钠,X为NaOH,步骤④盐酸和亚硫酸氢钠反应生成氯化钠、二氧化硫和水,最初的原料为NaCl,最终又有NaCl生成,同时回收二氧化硫.②过量的二氧化硫和氢氧化钠反应生成NaHSO3;④根据弱酸的酸式盐能与强酸反应分析.
解答 解:(1)黄铁矿的主要成分是FeS2,在沸腾炉中高温条件下与氧气反应生成二氧化硫和三氧化二铁,其反应方程式为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
故答案为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2; 沸腾炉;
(2)吸收塔中SO3如果用水吸收,发生反应:SO3+H2O═H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻碍水对三氧化硫的吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒浓硫酸作吸收液,最终得到“发烟”硫酸,
故答案为:98.3%浓硫酸;防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率;
(3)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),根据题意由表中数据可知,硫酸铜的质量分数随沸腾炉温度升高而降低,是因为反应CuO+SO3$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4中SO3的质量减少导致的,根据2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g),△H=-98.3kJ•mol-1反应制备SO3,该反应为可逆反应,正方向为放热,随着温度升高,平衡逆向移动,导致SO3的量减少,由CuO与SO3 在沸腾炉中化合而成CuSO4的量也减少,
故答案为:SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少);
(4)步骤①:电解饱和食盐水的方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,步骤②X溶液和二氧化硫反应生成亚硫酸氢钠,X为NaOH,步骤③反应条件为点燃,为氯气和氢气反应生成W为HCl,所以②为酸性气体二氧化硫与氢氧化钠反应生成亚硫酸钠和水,化学方程式为:SO2+NaOH=NaHSO3,步骤③弱酸的酸式盐NaHSO3与强酸HCl反应:NaHSO3+HCl=NaCl+SO2↑+H2O,
故答案为:SO2+NaOH=NaHSO3、NaHSO3+HCl=NaCl+SO2↑+H2O.
点评 本题考查工业接触法制硫酸的原理,同时涉及到反应原理、可逆反应的特点、反应的热效应、三氧化硫的吸收等内容,具有一定的综合性,需要一定的知识迁移能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
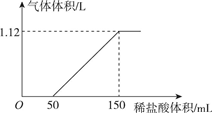 向某碳酸钠和碳酸氢钠的混合溶液中逐滴加入0.05mol/L的稀盐酸,加入稀盐酸体积与标准状况下产生气体体积的关系如图所示.
向某碳酸钠和碳酸氢钠的混合溶液中逐滴加入0.05mol/L的稀盐酸,加入稀盐酸体积与标准状况下产生气体体积的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 | B. | ll | C. | 13 | D. | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
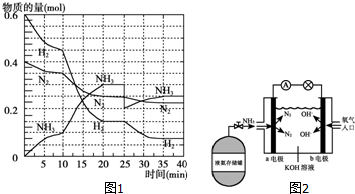 氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:
氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
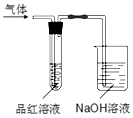 用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:
用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
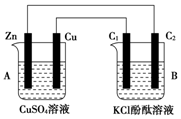 按图所示装置进行实验,并回答下列问题:
按图所示装置进行实验,并回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com