
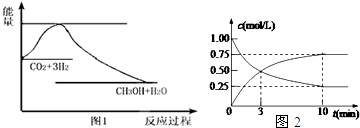
分析 (1)反应物总能量高于生成物总能量,反应为放热反应,正反应为气体物质的量减小的反应,则为熵减的反应;
(2)①由图2可知,CO2的浓度变化量为(1-0.25)mol/L=0.75mol/L,根据v=$\frac{△c}{△t}$计算v(CO2);
②A.升高温度平衡向吸热反应方向移动;
B.将CH3OH(g)及时液化抽出,生成物浓度减小,平衡正向移动;
C.选择高效催化剂,不影响平衡移动;
D.再充入l molCO2和4molH2,压强增大,平衡向气体体积减小的方向移动;
(3)计算1mol甲醇燃烧放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(4)碱性甲醇燃料电池为原电池,原电池负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水.
解答 解:反应物总能量高于生成物总能量,反应为放热反应,正反应为气体物质的量减小的反应,则为熵减的反应,即△H<0,△S<0,
故选:C;
(2)①由图2可知,CO2的浓度变化量为(1-0.25)mol/L=0.75mol/L,v(CO2)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),
故答案为:0.075mol/(L•min);
②A.正反应为放热反应,升高温度平衡逆向移动,故A错误;
B.将CH3OH(g)及时液化抽出,生成物浓度减小,平衡正向移动,故B正确;
C.选择高效催化剂,可以加快反应速率,但不影响平衡移动,故C错误;
D.再充入l molCO2和4molH2,压强增大,正反应为气体体积减小的反应,则平衡正向移动,故D正确,
故选:BD;
(3)16g 液态甲醇完全燃烧生成CO2和液态H2O时放出363.3kJ热量,则1mol甲醇燃烧放出的热量=363.3kJ×$\frac{1mol/L×32g/mol}{16g}$=726.6kJ,故热化学反应方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)→CO2(g)+2H2O(l)△H=-726.6kJ/mol,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)→CO2(g)+2H2O(l)△H=-726.6kJ/mol;
(4)碱性甲醇燃料电池为原电池,原电池负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
点评 本题考查化学平衡计算与影响因素、反应速率、热化学方程式、原电池等,属于拼合型题目,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1LCO2中含有3NA个原子 | |
| B. | 1molCl2含有1NA个原子 | |
| C. | 23g钠在足量的Cl2中反应,转移电子数NA个 | |
| D. | 欲配制1.00L1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
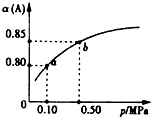 一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )
一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )| A. | 若容器内气体的密度保持不变,说明反应一定达到平衡状态 | |
| B. | 若在相同条件下,改为只加入0.5 mol C,则反应达到平衡反,放出热量Q1kJ | |
| C. | 平衡状态由a变到b时,则化学平衡常数K(a)=K(b) | |
| D. | 由图象可知,产物C一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:
“低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体密度 | B. | 容器内气体的压强 | ||
| C. | 混合气体的平均相对分子质量 | D. | A的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO固体(SiO2),加过量NaOH溶液充分反应,过滤、洗涤、干燥 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水溶解、蒸发、结晶、过滤、洗涤、干燥 | |
| D. | FeCl3溶液(CuCl2),过量铁粉,过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com