
分析 0.01mol/L NaOH溶液,c(OH-)=0.01mol/L,pH=11,则c(H+)=10-11mol/L,Kw=c(OH-)×c(H+),常温下Kw=10-14;
所得混合溶液为中性,Va:Vb=$\frac{{10}^{-b}}{{10}^{a-13}}$=1013-a-b,结合a+b的值计算(1)、(2)、(3);
(4)所得混合溶液的pH=10,碱过量,则$\frac{{V}_{a}×0.1mol/L{-V}_{b}×0.01mol/L}{{{V}_{a}+V}_{b}}$=0.001mol/L.
解答 解:0.01mol/L NaOH溶液,c(OH-)=0.01mol/L,pH=11,则c(H+)=10-11mol/L,Kw=c(OH-)×c(H+)=1.0×10-13,而常温下Kw=10-14,水的电离是吸热的,升高温度时水的电离平衡正向移动,Kw增大,则温度高于25℃,
故答案为:1.0×10-13;>;水的电离是吸热的,升高温度时水的电离平衡正向移动,Kw增大,因该温度下的Kw比25℃时大,所以该温度大于25℃;
(1)该温度下Kw=1.0×10-13,所得混合溶液为中性,Va:Vb=$\frac{{10}^{-b}}{{10}^{a-13}}$=1013-a-b,且a+b=14,解得Va:Vb=1:10,故答案为:1:10;
(2)所得混合溶液为中性,Va:Vb=$\frac{{10}^{-b}}{{10}^{a-13}}$=1013-a-b,且a+b=12,解得Va:Vb=10:1,故答案为:10:1;
(3)所得混合溶液为中性,Va:Vb=$\frac{{10}^{-b}}{{10}^{a-13}}$=1013-a-b,且a+b=x,解得Va:Vb=1013-(a+b):1 或1013-x:1,故答案为:1013-(a+b):1 或1013-x:1;
(4)所得混合溶液的pH=10,碱过量,则$\frac{{V}_{a}×0.1mol/L{-V}_{b}×0.01mol/L}{{{V}_{a}+V}_{b}}$=0.001mol/L,解得Va:Vb=1:9,故答案为:1:9.
点评 本题考查酸碱混合的计算,明确该温度下的Kw及pH与浓度的换算是解答本题的关键,注意酸碱反应的实质即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 450mL | B. | 500mL | C. | 400mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
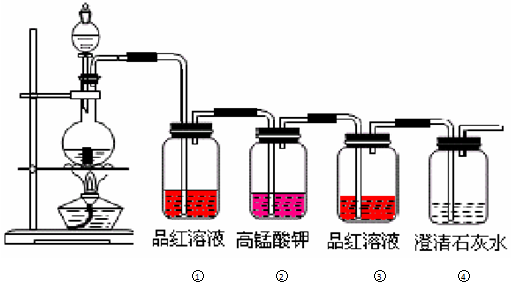
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
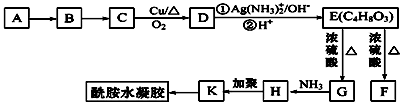
 ,K的结构简式为
,K的结构简式为 .
. .
. $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$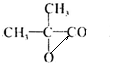 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在合成氨工业中,加压有利于提高NH3的产率 | |
| B. | 直接燃烧煤不如将煤进行深加工后再燃烧的效率好 | |
| C. | 化石燃料包括石油、天然气、煤和氢能 | |
| D. | 在时间允许的情况下,从节能上分析,步行>坐公交>坐出租车 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com