

分析 (1)①粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,由实验可知,加热溶解后,加NaOH除去Mg2+、Fe3+,加氯化钡除去SO42-,加碳酸钠除去Ca2+、Ba2+,碳酸钠一定在氯化钡之后,然后过滤,滤液中加盐酸除去过量碳酸钠溶液,调节pH后蒸发浓缩;
②洗涤NaCl晶体表面附带的少量KCl,NaCl在酒精中溶解度小,利用75%酒精洗涤,烘干得到NaCl;
(2)配制500mL4.00mol•L-1NaCl溶液,操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,根据实验步骤确定所用的仪器;
(3)根据电解饱和食盐水时的产物以及氯气和氢氧化钠的反应来回答;
(4)实验室中利用二氧化锰和浓盐酸加热来获得氯气,据此结合装置特点解答.
解答 解:(1)①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为NaOH、BaCl2、Na2CO3(或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH),碳酸钠一定在氯化钡之后,
故答案为:NaOH、BaCl2、Na2CO3(或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH);
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为75%乙醇,故答案为:75%乙醇;
(2)所以需要的仪器有托盘天平、烧杯、玻璃棒、500ml的容量瓶、胶头滴管、药匙,
故答案为:abdf;
(3)电解饱和食盐水的反应:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同样条件下收集到的Cl2小于2L,84消毒液的消毒的原理是次氯酸钠消毒杀菌最主要的作用方式是通过它的水解形成次氯酸
故答案为:电解生成的氯气与电解生成的NaOH发生了反应;次氯酸钠消毒杀菌最主要的作用方式是通过它的水解形成次氯酸.
(4)实验室中利用二氧化锰和浓盐酸加热来获得氯气,其中的杂质氯化氢可以加饱和食盐水来除,杂质水可以采用浓硫酸来除去,用向上排空气法收集,可以选择装置d,
故答案为:d.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中发生的反应、混合物分离提纯、溶液配制及电解等为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 | |
| C. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
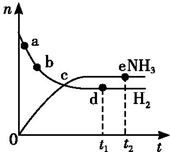 向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )
向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )| A. | c点表示NH3生成速率与NH3分解速率相等 | |
| B. | c点和e点H2的转化率相等 | |
| C. | 平衡后再升高温度,不利于氨的合成 | |
| D. | d点时:n(H2):n(NH3)=3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
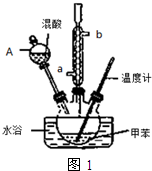 常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.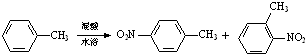
| 密度/g?cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a=b | C. | a<b | D. | 2a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 吸热反应一定需要加热才能发生 | |
| C. | 凡是放热反应的发生均无需加热 | |
| D. | 物质发生化学反应都伴随着能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大 | |
| B. | 当容器中气体压强不变时,反应达到平衡 | |
| C. | 升高温度,平衡逆向移动 | |
| D. | 改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2 mol、2 mol、6 mol | B. | 5 mol、2 mol、6 mol | ||
| C. | 4 mol、2 mol、5 mol | D. | 3 mol、2 mol、6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com