
ʵ������Ҫ1.0 mol��L-1NaOH��Һ400 mL��������Һ����������ش��������⣺
��1�� ��ͼ��ʾ��������������Һ�϶�����Ҫ���� ������ţ�������������Һ�����õ��IJ��������� �����������ƣ���
 |
��2�������й�����ƿ�Ĺ����ʹ�������У���ȷ���� ������ţ���
A����������һ������ġ�Ũ��ȷ����Һ
B������������Һ
C����������ƿ������µ����������Һ��
D������ƿ�ϱ����¶Ⱥ��ݻ�
E������һ�������Ũ�ȵ���Һʱ������ƿδ���������ҺŨ��ƫС
��3�����������������ƽ��ȡ����NaOH������Ϊ g����400mL���Ƶ���Һ��ͨ��0.3molCO2����������Һ�����ʵĻ�ѧʽΪ ��
 �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д� ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
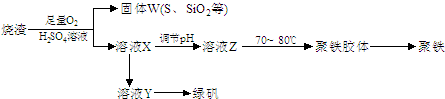
| ||
| ||
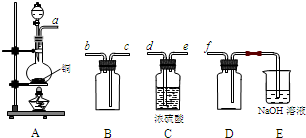
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
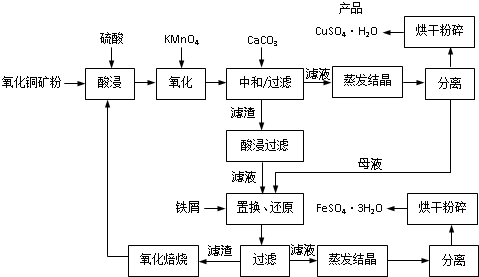
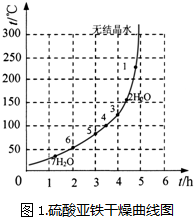
| ��� | t/h | t/�� | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
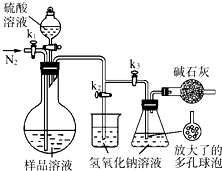 ��2013?������ģ��̼����-��������Ӻ��aNa2CO3?bH2O2������Ư�ס�ɱ�����ã�ʵ�����á����������Ʊ������ʵ�ʵ�鲽�����£�
��2013?������ģ��̼����-��������Ӻ��aNa2CO3?bH2O2������Ư�ס�ɱ�����ã�ʵ�����á����������Ʊ������ʵ�ʵ�鲽�����£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ������ | Ba2+ NH4+ Fe3+ Al3+ Fe2+ |
| ������ | OH- CO32- Cl- SO32- SO42- |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����


�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com