
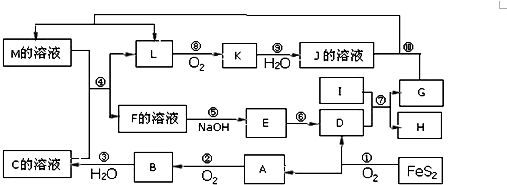
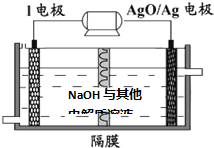
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
 (1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)?pC(g)+qD(S)△H<0如图1某反应过程中各物质物质的量n(mol)随时间t的变化曲线图.
(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)?pC(g)+qD(S)△H<0如图1某反应过程中各物质物质的量n(mol)随时间t的变化曲线图.查看答案和解析>>
科目:高中化学 来源: 题型:
| 牙膏品牌 | X牙膏 | Y牙膏 | Z牙膏 |
| 摩擦剂 | 氢氧化钠 | 碳酸钙 | 二氧化硅 |
| 摩擦剂的物质类别(指酸、碱、盐、氧化物) |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
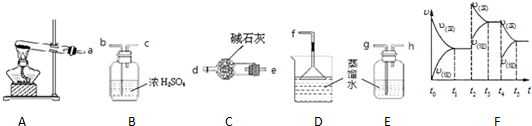
| 催化剂 |
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com